Основные понятия.
Теоретические основы химии

Объем, занимаемый при данных условиях мольной или эквивалентной массой газообразного вещества, называется мольным или, соответственно, эквивалентным объемом этого вещества. Мольный объем любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объем водорода (Vэ) молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4:2 = 11,2 л. Отношение mH2 /МЭ (Н2… Читать ещё >
Основные понятия. Теоретические основы химии (реферат, курсовая, диплом, контрольная)
Моль — количество вещества, содержащее столько реальных или условных частиц, сколько атомов содержится в 12 граммах углерода-12.
Символ количества вещества — n. Количество вещества x записывают как n (x).
Реальные частицы — это атомы, молекулы, ионы, электроны, радикалы и т. д.
Условные частицыэто какая-то часть реальной частицы, например, 1/5 молекулы.
Экспериментально установлено, что в 12 граммах углерода-12 содержится 6,022 1023 атомов углерода. Эта величина носит название числа Авогадро. Следовательно, 1 моль атомов, молекул, ионов или каких-либо других объектов содержит Авогадрово число этих объектов, например:
- 1 моль атомов Mg=6,221 023 атомов магния,
- 1 моль ионов Mg2+=6,221 023 ионов магния,
- 1 моль молекул KМnO4= 6,221 023 молекул перманганата калия.
Теоретическая часть.
Стехиометрия раздел химии, в котором рассматриваются количественные, массовые или объемные отношения между реагирующими веществами.
Основу стехиометрии составляют следующие стехиометрические законы:
- 1) закон сохранения массы веществ
- 2) закон постоянства состава
- 3) закон кратных отношений
- 4) закон простых объемных отношений
- 5) закон Авогадро
- 6) закон эквивалентов
Закон сохранения массы веществ: Общая масса веществ, вступающих в химическую реакцию, равна общей массе веществ, получающихся в результате реакции.
С точки зрения атомно-молекулярного учения, этот закон объясняется следующим образом: масса веществ является суммой масс составляющих их атомов. Так как при химических реакциях сами атомы не меняются и не меняется их общее количество, то сохраняется постоянной и соответствующая им общая масса.
Закон сохранения массы вещества является частным случаем более общего закона природы закона сохранения материи и движения:
Материя вечна, она не исчезает и не возникает из ничего, а только переходит из одной формы в другую.
Закон сохранения массы вещества служит основой для осуществления реакций между различными веществами. Исходя из него, можно производить разнообразные расчеты по уравнениям химических реакций.
Закон постоянства состава: Всякое чистое вещество молекулярной структуры, независимо от способов его получения, имеет постоянный качественный и количественный состав.
В настоящее время известен целый ряд веществ, например оксидов, сульфидов, нитридов (соединений металлов с азотом), карбидов (соединений металлов с углеродом), силицидов (соединений металлов с кремнием) и других кристаллических неорганических соединений, которые имеют немолекулярную структуру, их состав зависит от условий получения. Так, оксид титана (II) в действительности имеет состав от ТiO0,7 до ТiO1,3. Такого типа вещества немолекулярной структуры закону постоянства состава не подчиняются.
Закон кратных отношений: Если два элемента образуют друг с другом несколько химических соединений, массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Способность элементов вступать в соединения лишь определенными порциями свидетельствует о дискретном строении вещества. Например, азот и кислород дают 5 оксидов:
N2O, NO, N2O3, NO2, N2O5.
Количества кислорода в них, приходящиеся на одно и то же количество азота, относятся как целые числа — 1: 2: 3: 4: 5. Это объясняется тем, что одинаковое количество атомов азота в молекулах разных оксидов связано с различным числом атомов кислорода.
Закон простых объемных отношений: Объемы вступающих в реакцию газов относятся друг к другу, а также к объемам образующихся газообразных продуктов реакции, как небольшие целые числа.
Например, в реакции синтеза хлористого водорода из элементов, протекавшей по уравнению:
Н2 + Сl2 = 2НС1.
один объем водорода реагирует с одним объемом хлора и образуется два объема хлористого водорода (при одинаковых условиях).
V (Н2): V (Сl2): V (НС1) = 1: 1: 2.
Закон Авогадро: В равных объемах любых газов и паров при одинаковых условиях содержится одинаковое количество молекул.
Закону Авогадро подчиняются только газообразные вещества. В газах промежутки между молекулами велики по сравнение с их размерами, а собственный же объем молекул очень мал. Общий объем газов определяется, главным образом, расстояниями между молекулами, примерно одинаковыми у всех газов (при одинаковых внешних условиях).
Если вещество находится в твердом или жидком состоянии, то его объем зависит от размеров самих молекул. Допустим, мы имеем моль воды и моль этилового спирта. Учитывая, что молярная масса воды М (Н2О) = 18 г/моль, а плотность воды равна примерно 1 г/мл, найдем, что 1 моль воды, имеющий массу m = 18 г, займет объем при комнатной температуре:
V = m/ = 18 г/1 г/мл = 18 мл.
Моль этилового спирта, имеющий массу 46 г и плотность при тех же условиях (С2Н5ОН) = 0,8 г/мл, займет объем:
V = m/ = 46 г/0,8 г/мл = 57,5мл.
Если же воду и спирт испарить и полученные объемы паров привести к нормальным условиям, то они будут равны и составят 22 400 мл, то есть увеличатся в среднем в 1000 раз. Это говорит об увеличении расстояний между молекулами веществ при переходе их из твердого или жидкого состояния в газообразное.
Из закона Авогадро выведены следующие следствия:
Следствие I: Моль любого газа при нормальных условиях занимает один и тот же объем, равный приблизительно 22,4 л.
Этот объем называется молярным объемом и обозначается Vмол :
Vмол = 22,4 л/моль = 22,4 м3/кмоль.
Масса одного и того же объема газа тем больше, чем больше масса его молекул. Если в равных объемах газов при одинаковых условиях содержится одинаковое число молекул, то, очевидно, что отношение масс равных объемов газов будет равно отношению их молекулярных масс или отношению численно равных им молярных масс, то есть.
m1/m2 = M1/M2,.
где m1 масса объема первого газа, m2 масса такого же объема второго газа, М1 молярная масса первого газа, М2 молярная масса второго газа.
Отношение массы определенного объема одного газа к массе такого же объема другого газа, взятого при тех же условиях, называется относительной плотностью первого газа ко второму (обозначается буквой D).
D = m1/m2 при V1 = V2.
Относительная плотность первого газа по второму газу может быть рассчитана как отношение молярных масс этих газов.
D = M1/M2,.
Откуда М1 = М2 • D.
Обычно плотность газов определяют по отношению к водороду М (H2) = 2 г/моль или к воздуху М (возд.) = 29 г/моль.
Таким образом, зная плотность газа по водороду или по воздуху, можно легко определить его молярную, а, следовательно, и относительную молекулярную массу и сформулировать 2-е следствие из закона Авогадро.
Следствие II. Молярная масса вещества (М), а значит, и относительная молекулярная масса (Мr) вещества в газообразном состоянии численно равна удвоенной плотности паров этого вещества по водороду.
Измерения объемов газов обычно производят при условиях, отличных от нормальных.
Нормальными условиями считаются:
давление Р0 = 101,325 кПа (760 мм _Т. Ст., 1 атм.),.
температура Т0 = 273 К (t0 = 0 С).
Для приведения объема газа к нормальным условиям можно пользоваться уравнением, объединяющим газовые законы Бойля-Мариотта и Гей-Люссака:
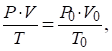
где V объем газа при давлении Р и температуре Т, V0 объем газа при нормальном давлении Р0 = 101,3 кПа и температуре Т0 = 273 К.
Закон эквивалентов: Из закона постоянства состава следует, что химические элементы соединяются друг с другом в строго определенных количественных соотношениях.
Возьмем, например, ряд соединений, в состав которых входит элемент водород: HCl — хлористый водород, H2O — вода, NH3 — аммиак, CH4 метан.
Атомы водорода соединяются со строго определенным числом атомов другого элемента, а поскольку атом каждого элемента имеет вполне определенную атомную массу, то количества соединяющихся друг с другом элементов строго определены. Так, в приведенных соединениях, формулы которых НС1, Н2О, NH3 и СН4, на 1 атом водорода приходится: 1 атом хлора, ½ атома кислорода, 1/3 атома азота, ¼ атома углерода.
Химическим эквивалентом элемента называется реальная или условная частица, которая может присоединять, замещать, высвобождать или каким — либо другим образом быть равноценна одному иону водорода H+ в ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Исходя из определения, эквивалент для водорода равен 1 атому, а все, что соединяется, замещает или иным образом соответствует 1 атому водорода, будет эквивалентом другого вещества.
Так, в вышеприведенных соединениях НСl, Н2О, NН3 и СН4 эквивалент хлора будет равен 1 атому, кислорода — ½ атома, азота — 1/3 атома и углерода — ¼ атома. 3 последние частицы являются не реальными, а условными.
Эквивалент элемента в соединении легко рассчитать по формуле:
Э = 1/В,.
где Э — эквивалент элемента;
В — валентность элемента в соединении.
Количество эквивалентов вещества выражают в молях.
Масса 1 моль эквивалентов вещества называется молярной массой его эквивалента (Mэкв).
Размерность молярной массы эквивалента — [г/моль].
Молярную массу эквивалента элемента можно рассчитать по формуле:
Mэкв = М/В, где Mэкв — молярная масса эквивалента элемента; М — молярная масса элемента; В — валентность элемента в соединении.
Так, в приведенных выше примерах молярные массы эквивалентов хлора, кислорода, азота и углерода соответственно равны:
Мэкв (Cl) = 35,5/1 = 35,5 г/моль, Мэкв (O) = 16/2 = 8 г/моль, Мэкв (N) = 14/3 = 4,66 г/моль, Мэкв © = 12/4 = 3 г/моль.
Понятия об эквивалентах и молярных массах эквивалентов распространяются также на сложные вещества.
Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества.
Для определения эквивалентов простых и сложных веществ удобно использовать понятие фактор эквивалентности f.
Фактором эквивалентности для вещества (f) называется число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода H+ в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Эквивалент элемента можно рассчитать по формуле:
Э = 1 • fэлем. = 1/В.
В свою очередь, фактор эквивалентности может быть найден:
для элемента — fэлем. = 1/валентность элемента для кислоты — fкислоты = 1/основность кислоты для основания — fоснования = 1/кислотность основания для соли (средней) — fсоли. = 1/n • В, где n — число атомов металла, В — валентность металла.
Таким образом, эквиваленты и молярные массы эквивалентов простых и сложных веществ можно рассчитать по формулам, приведенным в табл. 1.1. Как видно из приведенных формул, молярная масса эквивалента, как элемента, так и сложного вещества не всегда является постоянной величиной. Эквивалент и молярная масса эквивалента элемента зависят от валентности, которую проявляет элемент в соединении.
Таблица 1.2 Эквиваленты и молярные массы эквивалентов.
Элемент или сложное вещество. | Эквивалент Э,. | Молярная масса (М экв.) эквивалента, [г/моль]. |
Элемент Например, Са. | Ээл = 1• f =1/В Э (Ca) = ½. | Мэкв =M • f = M/В М (ЅCa) = 40/2 = 20 г/моль. |
Кислота Например, H2S. | Э кислоты = 1• f = = 1/основность Э кислоты = 1• f = =1/основность. | Мэкв =M • f =. M/основность М (ЅН2S).=34 • ½ =. = 17 г/моль. |
Основание Например, Са (OH)2. | Эосн = 1• f =. = 1/кислотность Э [Ca (OH)2] = ½. | Мэкв =M • f =. = M/кислотность М[ЅCa (OH)2] =. = 74 / 2 = 37 г/моль. |
Соль Например, Al2S3. | Эсоли = 1• f = 1 / n • В =. = Э [Al2S3] = ½ • 3 = 1/6. | М экв =M • f =. = M / n • В М (1/6 Al2S3) =. = 150 / 6 = 25 г/моль. |
Эквивалент и молярная масса эквивалента сложного вещества определяются конкретной реакцией, в которой участвует данное вещество.
Пример 1.
Чему равен эквивалент и молярная масса эквивалента серной кислоты в реакциях с раствором щелочи, если образуется:
а) NаНSО4 и б) Nа2SО4?
Решение.
А) В реакции с образованием гидросульфата натрия серная кислота нейтрализуется не полностью:
Н2SО4 + NаОН = NаНSO4 + Н2О.
В этой реакции серная кислота проявляет основность равную 1. Из этого следует, что фактор эквивалентности этой кислоты в данной реакции равен 1. Найдем значение эквивалента кислоты в данной реакции:
Э (H2SO4) =1• f = 1/основность = 1.
Найдем значение молярной массы эквивалента кислоты:
Мэкв (H2SO4) =M • f = M/основность = 98/1 = 98 г/экв, б) Сульфат натрия образуется при полной нейтрализации кислоты:
Н2SО4 + 2NаОН = Na2SO4 +2Н2О.
В этой реакции основность, проявляемая Н2SO4, равна 2 и значение фактора эквивалентности в этом случае равно 2.
Отсюда:
Э (H2SO4) =1 • f = 1/основность = ½ моль, Мэкв (ЅH2SO4) = M/основность = 98/2= 49 г/моль.
Для газообразных веществ удобно пользоваться понятием молярный объем эквивалента (Vэкв).
Молярный объем эквивалента представляет собой объем одного моль эквивалентов газообразного вещества при нормальных условиях. Размерность молярного объема эквивалента [л/моль].
Так, 1 моль эквивалентов водорода (один моль атомов Н) имеет массу 1 г.
Пример 2.
Используя следствие из закона Авогадро, рассчитать объем, занимаемый одним эквивалентом водорода.
Решение.
- 1 моль молекул Н2 имеет массу 2 г и занимает объем 22,4 л, а объем, занимаемый одним эквивалентом водорода (одним моль атомов элемента водорода), который имеет массу 1 г, найдем из пропорции:
- 2 г Н2 > 22,4 л
- 1 г Н2 > х л
x = 11,2 л, т. е. Vэкв (H) =11,2 л/моль.
Аналогично можно рассчитать молярный объем эквивалента для кислорода, который будет равен:
Vэкв (ЅO) = 5,6 л/моль.
Введение
в химию понятия «эквивалент» позволило сформулировать закон, называемый законом эквивалентов: массы реагирующих друг с другом веществ пропорциональны молярным массам их эквивалентов.
Закон эквивалентов можно записать в следующем виде:

где m1 и m2 массы взаимодействующих веществ; Мэкв.1 и Мэкв.2 молярные массы эквивалентов.
Если вещества находятся в газообразном состоянии, удобно пользоваться понятием «молярный объем эквивалента» и следующей формулировкой закона эквивалентов: объемы реагирующих друг с другом газообразных веществ пропорциональны молярным объемам их эквивалентов.
V1/V2 = Vэкв1/Vэкв2 ,.
где.
V1 и V2 объемы реагирующих газообразных веществ,.
Vэкв1 и Vэкв2 молярные объемы их эквивалентов.
Пример 3.
Выразите в молях:
- а) 6,02· 1021 молекул СО2;
- б) 1,20· 1024 атомов кислорода;
- в) 2,00· 1023 молекул воды. Чему равна мольная (молярная) масса указанных веществ?
Решение. Моль — это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро (6,02· 1023). Отсюда.
- а) 6,02· 1021, т. е. 0,01 моль;
- б) 1,20· 1024, т. е. 2 моль;
- в) 2,00· 1023, т. е. 1 /З моль.
Масса моля вещества выражается в г/моль. Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м).
Так как молекулярные массы СО2 и Н2О и атомная масса кислорода соответственно равны 44, 18 и 16 а.е.м., то их мольные (молярные) массы равны:
- а) 44 г/моль;
- б) 18г/моль;
- в) 16 г/моль.
Пример 4.
Вычислите значение грамм-эквивалента серной кислоты, гидроксида кальция и сульфата алюминия.
Решение:
ЭH2SO4 =МH2SO4 /2=98/2=49г ЭСа (OH)2 =МСа (OH)2 /2=74/2=37г Э Al2(SO4)3 = М Al2(SO4)3 / (2· 3) = 342 / 2= 57 г Пример 5.
На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите эквивалентную массу оксида и эквивалентную массу металла. Чему равна атомная масса металла?
Решение.
Нормальные условия по Международной системе единиц (СИ): давление 1,013· 105 Па (760 мм _Т. Ст., 1 атм), температура 273 К или 0 °C.
Согласно закону эквивалентов.
m1/Мэ (1) = m2/Мэ (2).
m (МеО)/Мэ (МеО) = m (Н2)/Мэ (Н2).
Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах (мл, л, м 3).
Объем, занимаемый при данных условиях мольной или эквивалентной массой газообразного вещества, называется мольным или, соответственно, эквивалентным объемом этого вещества. Мольный объем любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объем водорода (Vэ) молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4:2 = 11,2 л. Отношение mH2 /МЭ (Н2) заменяем равным ему отношением VH2 /VЭ (Н2), где VH2 — объем водорода, VЭ (Н2) эквивалентный объем водорода:
m (МеО)/Мэ (МеО) = V (Н2)/Vэ (Н2).
Находим эквивалентную массу оксида металла МЭ (МеО).
7,09/МЭ (МеО) = 2,24/11,2;
МЭ (МеО) = 7,09· 11,2/2,24 = 35,45 г/моль.
Согласно закону эквивалентов.
МЭ (МeO) = МЭ (Мe) + МЭ (O2),.
МЭ (Мe) = МЭ (МeО) — МЭ (O2) = 35,45 — 8 = 27,45 г/моль.
Мольная масса металла определяется из соотношения:
МЭ = А/В, где: МЭ — эквивалентная масса, г/моль, А — мольная масса металла, г/моль В — валентность элемента;
А = Мэ· В = 27,45*2 = 54,9 г/моль.
Так как атомная масса в а.е.м. численно равна мольной (молярной) массе, выражаемой в г/моль, то искомая атомная масса металла 54,9 а.е.м.
Пример 6.
При 25 0С и давлении 93 кПа. (745 мм _Т. Ст.) некоторое количество газа занимает объем 152 мл. Найти, какой объем займет это же количество газа при 0 0С и давлении 101,33 кПа.
Решение.
Подставляя данные задачи в последнее уравнение, получаем:

0,075 г металла вытесняет из раствора соли никеля 0,183 г никеля, а из раствора кислоты — 70 мл водорода, измеренного при нормальных условиях. Определите молярные массы эквивалентов металла и никеля. Ответ: 29,35 г/моль При сгорании трёхвалентного металла в количестве 23,48 г было получено 44,40 г его оксида. Какой металл был сожжен? Определите массу оксида. Ответ: Al2O3; 17 г/моль.
Определите молярные массы эквивалентов кислот и гидроксидов в реакциях:
H2SO4 + 2NaOH = Na2SO4 + 2H2O Ответ: 49 г/моль.
2H3PO4 + Ca (OH)2 = Ca (H2PO4)2 + 2H2O Ответ: 98 г/моль.
Al (OH)3 + 3NaCl = AlCl3 + 3NaOH Ответ: = 26 г/моль.
Zn (OH)2 + NaCl = ZnOHCl + NaOH Ответ: 99,4 г/моль На реакцию с 13,61 г дигидрофосфата калия израсходовано 5,61 г гидроксида калия. Вычислите молярную массу эквивалента дигидрофосфата калия и напишите уравнения реакции. Ответ: 136,1 г/моль Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла (МЭ (Ме)). Ответ: 15 г/моль.
В какой массе Са (ОН)2 содержится столько же эквивалентов, сколько в 312 г А1(ОН)3? Ответ: 444 г.
Вычислите абсолютную массу молекулы серной кислоты в граммах. Ответ: 1,63* 10−22.
На восстановление 3,6 г оксида двухвалентного металла израсходовано 1,7 л водорода (н.у.). Вычислить молярные массы эквивалента оксида и металла. Ответ: 15,72 г.
Объемное содержание углекислого газа в воздухе составляет 0,03% (н.у.). Найти количество (моль) и массу (г) СО2, содержащегося в 0,5 м³ воздуха. Ответ: 0,295 г.
Масса колбы вместимостью 750 мл, наполненной при 27С кислородом, равна 83,3 г. Масса пустой колбы составляет 82,1 г. Определить давление кислорода в колбе. Ответ: 124,65 кПа.
При сгорании 5,00 г трехвалентного металла образовалось 9,45 г его оксида. Определите молярную массу эквивалента этого металла и назовите металл. Ответ: 27 г.
0,978 г щелочного металла реагирует с 0,200 г кислорода и с 3,17 г галогена. Определите эквивалент галогена и назовите его. Ответ: галоген — I.
Чему равен эквивалент щелочноземельного металла и его оксида, если известно, что 0,608 г металла вытесняют из раствора соляной кислоты 0,560 л водорода (н.у.)? Определите металл. Ответ: металл — Mg.
- 0,200 г двухвалентного металла вытеснили 197 см³ водорода, который был собран под водой и измерен при 20єС и 780 мм Hg. Давление насыщенных паров воды при этих условиях составляет 17,4 мм Hg. Определите, какой это металл. Ответ: металл — Mg.
- 3,16 г перманганата калия взаимодействуют с концентрированной соляной кислотой. Образующийся хлор пропустили в раствор иодида калия. Сколько граммов иода выделилось, если общий выход реакций составил 80%? Ответ: 10,2 г.
Определите эквивалент и эквивалентные массы элементов в соединениях с водородом: H2O, HCl, PH3. Ответ: 8 г/моль, 35,5 г/моль, 10,3 г/моль.
Определите эквивалентные массы следующих соединений: CO2, H2SO4, Cu (OH)2, MgCl2. Ответ: 11 г/моль, 49 г/моль, 49 г/моль, 47,5 г/моль.
На нейтрализацию кислоты массой 2,18 г израсходовано KOH массой 2,49 г. Определите эквивалентную массу кислоты. Ответ: 49 г/моль.
Определите массу металла, вступившего в реакцию с кислотой, если при этом выделился водород объёмом 260 мл при нормальных условиях. Эквивалентная масса металла mэ (Ме) = 9 г/моль. Ответ: 0,2 г.
Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла. Ответ: 15 г/моль.
При взаимодействии магния с кислородом образуется оксид магния. Определите массу магния, необходимую для реакции с кислородом массой 64 г, а также массу образующегося при этом оксида. Ответ: m (Мg) = 96 г, m (MgO) = 160 г.
Чему равны массы цинка и серы, необходимые для получения сульфида цинка массой 485 г? Ответ: m (MgO) = 325 г, m (S) = 160 г.
Определите массу хлорида калия, образующегося при взаимодействии хлористого водорода массой 219 г с раствором, содержащим гидроксид калия массой 224 г. Ответ: 298 г.
При 25С и давлении 745 мм _Т. Ст. некоторое количество газа занимает объем 152 мл. Вычислить, какой объем займет это же количество газа при нормальных условиях. Ответ: 136,5 мл.
Чему равны значения а) относительной плотности хлора по воздуху, б) массы 1 л хлора (при н.у.), в) объема 1 л хлора (при н.у.). Ответ: а) 2,45; б) 3,17 г; в) 0,3 л.
При растворении металла массой 0,0548 г в избытке раствора кислоты выделялся водород объемом 50,4 мл (н.у.). Вычислите значение молярной массы эквивалента металла. Ответ: 12,17 г/моль.
Вычислить эквивалент и молярную массу эквивалента ортофосфорной кислоты в реакциях: а) с магнием, б) с гидроксидом калия, если при этом образуется кислая соль K2HPO4. Ответ: а) 32,67 г/моль; б) 49 г/моль.
При окислении металла массой 8,43 г образовался оксид массой 9,63 г. Вычислите значения молярных масс эквивалентов металла и его оксида. Ответ: 64,2 г/экв.
Вычислите значения относительной атомной массы и молярной массы эквивалента некоторого элемента, зная, что массовая доля данного элемента в его оксиде составляет 46,74% и что на один атом его в оксиде приходится два атома кислорода. Ответ: 28,08 г/моль.
Масса 0,327 · 10−3 м3 газа, при 13 оС и давлении 1,04 · 105 Па равна 0,828 · 10−3 кг. Вычислить молярную массу газа. Ответ: 57,8 * 10−3 кг/моль.