Закон Гесса и его следствия

Пример 5. Написать термохимическое уравнение реакции сгорания твердой серы в N2O, если известно, что при сгорании 16 г серы выделяется 66,9 кДж тепла (предполагается, что при измерении теплоты температура продуктов снижается до температуры реагентов, равной 298 К). С помощью закона Гесса и его следствий можно определять многие величины, в том числе не определяемые экспериментально, если… Читать ещё >
Закон Гесса и его следствия (реферат, курсовая, диплом, контрольная)
В основе термохимических расчетов лежит закон открытый российским ученым Гессом Г. И. (1841 г.). Суть его в следующем: тепловой эффект химической реакции зависит только от начального и конечного состояния системы, но не зависит от скорости и пути процесса, то есть от числа промежуточных стадий. Это, в частности, значит, что термохимические реакции можно складывать вместе с их тепловыми эффектами. Например, образование CO2 из углерода и кислорода можно представить следующей схемой:
С+О2 Н1 СО2 1. C (граф.) +O2 (г) = CO2 (г), Н01 = 396 кДж.
2. C (граф.) + ½O2 (г) = CO (г), Н02 = Х кДж.
Н2 Н3.
3. CO (г) + ½O2 (г) = CO2 (г), Н03 = 285,5кДж.
СО + ЅО2.
Все эти три процесса находят широкое применение в практике. Как известно, тепловые эффекты образования СО2 (Н1) и горения СО (Н3) определяются экспериментально. Тепловой же эффект образования СО (Н2) экспериментально измерить невозможно, так как при горении углерода в условиях недостатка кислорода образуется смесь СО и СО2. Но энтальпию реакции образования СО из простых веществ можно рассчитать.
Из закона Гесса следует, что H01 = H02 + H03. Следовательно,.
H02 = H01 H0 3 = 396 (285,5) = 110,5 (кДж) — это и есть истенная величина Таким образом, пользуясь законом Гесса, можно находить теплоту реакций, которые невозможно определить экспериментально.
В термохимических расчетах широко используют два следствия закона Гесса. По первому, тепловой эффект реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (реагентов).
Н0х.р. = nпродH0ѓ прод — nисх Н0ѓ реагентов,.
где n количество вещества; Н0ѓ стандартная энтальпия (теплота) образования вещества.
Тепловой эффект реакции образования 1 моль сложного вещества из простых веществ, определенный при стандартных условиях, называется стандартной энтальпией образования этого вещества (Н0образ или Н0ѓ кДж/моль).
Так как абсолютную энтальпию вещества определить невозможно, то для измерений и расчетов необходимо определить начало отсчета, то есть систему и условия, для которых принимается значение: Н = 0. В термодинамике в качестве начала отсчета принимают состояния простых веществ в их наиболее устойчивых формах при обычных условиях — в стандартном состоянии.
Например: Н0ѓ (О2) = 0, но Н0ѓ (О3) = 142,3 кДж/моль. Стандартные энтальпии образования определены для многих веществ и проведены в справочниках (табл. 5.1).
В общем виде для реакции аА+ вВ = сС + dD энтальпия, согласно первому следствию определяется по уравнению:
H0298 х.р.= (cН0ѓ, C + dН0ѓ, Е) (аH0ѓ, A + вH0ѓ, B).
Второе следствие закона Гесса относится к органическим веществам. Тепловой эффект реакции с участием органических веществ равен сумме теплот сгорания реагентов за вычетом теплот сгорания продуктов.
При этом теплота сгорания определяется в предположении полного.
сгорания: углерод окисляется до CO2, водород до H2O, азот до N2 .
Тепловой эффект реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов называется теплотой сгорания этого вещества (Н0сг.). При этом очевидно, что теплоты сгорания O2, CO2, H2O, N2 принимаются равными нулю.
Таблица 1.1.
Термодинамические константы некоторых веществ.
Вещество. | Н0f, 298, кДж/. моль. | S0298, Дж/. моль?K. | G0f, 298, кДж/. моль. | Вещество. | Н0f, 298, кДж/. моль. | S0298,. Дж/. моль?K. | G0f, 298,. кДж/моль. |
Al2O3(кр). | 1676,0. | 50,9. | 1582,0. | Cr2O3(кр). | 1140,6. | 281,0. | 1059,0. |
BaO (кр). | 558,1. | 70,3. | 528,4. | CuO (кр). | 162,0. | 42,6. | 129,4. |
ВеО (кр). | 598,0. | 14,1. | 581,6. | CuCl2(ж). | 227,6. | 210,9. | 244,6. |
BeCO3(кр). | 982,0. | 67,3. | 944,8. | H2O (ж). | 285,8. | 70,08. | 237,3. |
С (графит). | 5,7. | H2O (г). | 241,8. | 188,7. | 228,6. | ||
Cl2(г). | 222,9. | H2SO4(ж). | 814,2. | 156,9. | 690,3. | ||
CaO (кр). | 635,5. | 39,7. | 604,2. | HCl (ж). | 166,9. | 56,5. | 131,2. |
CaH2(кр). | 188,7. | 42,0. | 149,8. | HCl (г). | 91,8. | 186,7. | 94,8. |
CaCO3(кр). | 1206,9. | 92,9. | 1128,8. | H2S (г). | 21,0. | 205,6. | 33,8. |
O2(г). | 205,0. | H2. | 130,5. | ||||
Ca (OH)2. | 986,6. | 76,1. | 896,8. | NH3(г). | 46,2. | 192,5. | 16,7. |
CH4. | 74,9. | 186,2. | 50,8. | NO. | 90,3. | 210,6. | 86,6. |
C2H4. | 52,3. | 219,4. | 68,1. | NO2. | 33,0. | 240,5. | 51,5. |
C2H6. | 89,7. | 229,5. | 32,9. | NH4Clкр | 314,2. | 94,5. | 203,2. |
C6H6(ж). | 82,9. | 269,2. | 129,7. | P2O5(кр). | 114,5. | 1348,8. | |
C2H2. | 226,8. | 200,8. | 209,2. | SO3(ж). | 439,0. | 122,1. | 368,1. |
C3H8(г). | 103,85. | 269,9. | Fe. | 27,2. | |||
CH3OH (ж). | 126,8. | FeO (кр). | 264,8. | 60,7. | 244,3. | ||
C2H5OH (г). | 235,3. | Fe3O4(кр). | 1117,1. | 146,2. | 1014,2. | ||
CO. | 110,5. | 197,5. | 137,1. | Fe2O3(кр). | 822,2. | 89,9. | 740,3. |
CO2. | 393,5. | 213,6. | 394,3. | Ti (кр). | 30,6. | ||
CS2(г). | 115,3. | TiO2(кр). | 943,9. | 50,3. | 888,6. |
Например, теплоту сгорания этанола.
C2H5OH (ж) + 3O2 = 2CO2 + 3H2O (г) можно рассчитать по уравнению:
H0х.р. = Н0сг (C2H5OH) = 2Н0ѓ,(CO2) +3Н0ѓ,(H2O) Н0ѓ,(C2H5OH).
Н0сг (C2H5OH) = 2(393,5) + 3(241,8) — (277,7) = 1234,7 кДж/моль.
Значения теплот сгорания также приведены в справочниках.
Пример 1. Определить тепловой эффект реакции дегидратации этанола, если.
H0сг (C2H4) = 1422,8; H0сг (H2О) = 0; Н0сг (C2H5OH) = 1234,7 (кДж/моль).
Решение. Запишем реакцию: C2H5OH (ж) = C2H4 + H2O.
Согласно второму следствию определяем тепловой эффект реакции по теплотам сгорания, которые приведены в справочнике:
H0298 х. р = H0сг (C2H5OH) H0сг (C2H4) H0сг (H2O) =.
1234,7 + 1422,8 = 188,1 кДж/моль.
В технике для характеристики тепловых качеств отдельных видов топлива обычно используют их теплотворную способность.
Теплотворной способностью топлива называется тепловой эффект, который соответствует сгоранию единицы массы (1 кг) для твердых и жидких видов топлива или единицы объема (1 м3) для газообразного топлива (табл. 5.2).
Таблица .2.
Теплотворная способность и состав некоторых распространенных видов топлива.
Топливо. | Содержание, %. | Теплотворная способность,. кДж/г. | ||
углерод. | водород. | кислород. | ||
Антрацит*. | ||||
Бензин. | ||||
H2. | ||||
Древ. уголь. | ||||
Прир. газ. | ||||
Сырая нефть. |
* Антрацит — каменный уголь с максимальным содержанием углерода (94−96%).
Водород является наиболее эффективным химическим энергоносителем для энергетики, транспорта и технологии будущего, поскольку имеет очень высокую теплотворную способность (табл. 4.2), его относительно легко транспортировать, а при его сгорании образуется только вода, т. е. он является «чистым» горючим, не вызывает загрязнения воздуха. Однако, его широкому использованию в качестве источника энергии мешает слишком малое содержание водорода в природе в свободном состоянии. Большую часть водорода получают разложением воды или углеводородов. Однако, такое разложение требует большого расхода энергии, причем на практике из-за тепловых потерь на получение водорода приходится затратить больше энергии, чем ее потом можно будет получить. В перспективе, если удастся создать большие и дешевые источники энергии (например, в результате развития техники получения ядерной или солнечной энергии), часть ее будет использоваться на получение водорода. Многие ученые убеждены, что энергетика будущего — это водородная энергетика.
С помощью закона Гесса и его следствий можно определять многие величины, в том числе не определяемые экспериментально, если соответствующую неизвестной величине реакцию можно получить, складывая другие реакции с известными характеристиками.
Пример 2. Исходя из теплоты сгорания СН4 (Н0сг = 890кДж/моль) и Н2 (Н0сг = 286 кДж/моль), вычислить теплотворную способность газа, содержащего 60% водорода и 40% метана СН4.
Решение. Запишем термохимические уравнения реакций сгорания:
1) Н2 + ЅО2 = Н2О (ж); Н0f (Н2О) = 286 кДж/моль;
СН4 + 2О2 = СО2 + 2Н2О (ж); Н02.
H02 = Н0ѓ,(CO2) + 2Н0ѓ,(Н20) Н0ѓ,(СН4) = 393 2.286 + 75 = 890 кДж/моль.
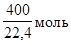
1 м³ газа содержит 600л Н2 и 400л СН4, что составляет Н2 и СН4. Теплотворная способность газа составит:
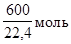
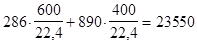
кДж/м3.
Пример 3. Используя данные таблицы 5.1, рассчитать тепловой эффект реакции сгорания этилена: С2Н4 + 3О2 = 2СО2 + 2Н2О (г).
Решение. Из таблицы 5.1 выписываем значения энтальпий образования веществ, участвующих в реакции (в кДж/моль):
H0ѓ, co2 = 393,5; Н0ѓ, с2н4 = 52,3; Н0ѓ, н2о = 241,8.
(Напомним, что энтальпия образования простых веществ равна нулю.).
Согласно следствию из закона Гесса (4.4):
H0298 х. р = nпродН0ѓ, прод nисхН0ѓ, исх = 2Н0ѓ, со2 + 2Н0ѓ, н2о Н0ѓ, с2н4 = 2. (393,5) + 2. (241,8) 52,3 = 1322,9 кДж.
Пример 4. Исходя из теплового эффекта реакции.
3СаО (т) + Р2О5 (т) = Са3(РО4)2 (т), Н0 = 739 кДж, определить энтальпию образования ортофосфата кальция.
Решение. По следствию из закона Гесса:
H0298 х. р = Н0ѓ, Са3(PO4)2 (3Н0ѓ, СаО + Н0ѓ, P2O5).
Из табл. 1.1: Н0ѓ, (СаО) = 635,5; Н0ѓ, (P2O5)= 1492 (кДж/моль).
Н0ѓ, Са3(PO4)2 = 739 + 3. (635,5) 1492 = 4137,5 кДж/моль.
Пример 5. Написать термохимическое уравнение реакции сгорания твердой серы в N2O, если известно, что при сгорании 16 г серы выделяется 66,9 кДж тепла (предполагается, что при измерении теплоты температура продуктов снижается до температуры реагентов, равной 298 К).
Решение. Чтобы записать термохимическое уравнение, надо рассчитать тепловой эффект реакции:
S (т) + 2N2O (г) = SO2 (г) + 2N2 (г); H0 = Х кДж.
По условию задачи известно, что при сгорании 16 г серы выделяется 66,9 кДж, а в реакции участвует 32 г серы. Составляем пропорцию:
- 16 г 66,9 кДж
- 32 г X кДж X = 133,8 к Дж.
Таким образом, термохимическое уравнение записывается так:
S (т) + 2N2O (г) = SO2 (г) + 2N2 (г), Н0 х.р.= 133,8 кДж.
(Так как тепло выделяется, реакция экзотермическая, Н0 0).
Пример 6. Какое количество теплоты выделится при соединении 5,6 л водорода с хлором (н. у.), если энтальпия образования хлористого водорода равна 91,8 кДж/моль (температура продуктов и реагентов равна 25 С).
Решение. Н0ѓ,(HCl) = -91,8 кДж/моль, это значит, что при образовании одного моля HCl из простых веществ выделяется 91,8 кДж тепла, что соответствует термохимическому уравнению:
Ѕ Cl2 + Ѕ H2 = HCl, H0ѓ = 91,8 кДж.
Из уравнения видно, что для получения 1 моль HCl расходуется 0,5 моль Н2,.
т. е. 0,522,4 л = 11,2 л. Составляем пропорцию:
11,2 л 91,8 кДж.
5,6 л X X = 45,19 кДж.
Ответ: выделится 45,19 кДж тепла.
Пример 7. Определить энтальпию образования оксида железа (III), исходя из трех термохимических уравнений (справочником не пользоваться):
Fe2O3 + 3CO = 2Fe + 3CO2, Н01 = 26,5 кДж;
С (графит) + Ѕ O2 = CO, Н02 = 110,4 кДж;
СO2 = C (графит) + O2, Н03 = + 393,3 кДж.
Решение: Запишем уравнение, тепловой эффект которого нужно определить:
4Fe + 3O2 = 2Fe2O3; Н04 = 2Х кДж.
Чтобы из первых трех уравнений получить четвертое, надо уравнение 1) умножить на (2), а уравнения 2) и 3) — на (6) и сложить:
- 1) 4Fe + 6CO2 = 2Fe2O3 + 6CO, Н01 = 2· (+26,5) кДж;
- 2) 6CO = 6С (графит) + 3O2, Н02 = 6· (+110,4) кДж;
- 3) 6C (графит) + 6O2 = 6СO2, Н03 = 6· (393,3) кДж;
Н04 = 2Н01 + 6Н02 + 6Н03 = +53 + 662,4 2359,8 = 1644,4 кДж.
Отсюда Н0ѓ (Fe2O3) = 822,2 кДж/моль.
термодинамика химический гесс энтальпия.