Кинетические характеристики ионообменной сорбции катионов ртути на железомарганцевых конкрециях

При времени ионного обмена катионов менее 2 минут процесс протекал с большой скоростью в нестационарном режиме. В начальный момент времени, когда ЖМК вносили в раствор, концентрация Hg2+ на их поверхности CS = 0, и градиент концентрации в слое Нернста максимален. Затем, с ростом CS, скорость диффузии и скорость процесса ионного обмена выравниваются, и устанавливается постоянный градиент… Читать ещё >
Кинетические характеристики ионообменной сорбции катионов ртути на железомарганцевых конкрециях (реферат, курсовая, диплом, контрольная)
Кинетические характеристики ионообменной сорбции катионов ртути на железомарганцевых конкрециях
В данной статье проведены кинетические характеристики процесса ионообменной сорбции катионов ртути на железомарганцевых конкрециях (ЖМК) как научное обоснование применения ЖМК, определены константы скорости реакции при различных температурах, кажущаяся энергия активации процесса. Процесс ионного обмена описывается кинетическим уравнением первого порядка и ограничивается внешней диффузией.
Ключевые слова: внешняя диффузия, железомарганцевые конкреции, ионообменная сорбция, энергия активации В настоящее время все более широкое распространение получает сорбционное извлечение металлов из сбросных технологических растворов и сточных вод вследствие высокой эффективности метода и отсутствия вторичных загрязнений.
Перспективным природным сорбционном материалом для очистки сточных вод и сбросных технологических растворов являются железомарганцевые конкреции (ЖМК) [1−8], емкость по железу (2+) ЖМК составляет от 46,34 до 123,56 г/кг (в расчете на сухой сорбент) против 3,25 г/кг импортного аналога типа «Аквамандикс» [9], удельная поверхность составляет 43,81 м2/г. В данной работе исследовали скорость ионного обмена катионов ртути на катионы натрия на поверхности ЖМК. Известно, что при производстве хлора и каустика ртутным методом в сточных водах находится значительное количество катионов ртути.
Скорость ионного обмена катионов Hg (2+) и Na+ на ЖМК изучали в статических условиях. В термостат помещали колбу, заполненную исследуемым раствором соли Hg (NO3)2 с концентрацией 0,023 — 0,025 моль/л, и термостатировали при различных температурах и соотношениях объема жидкой фазы V (мл) к массе твердого образца m (г) V/m=100; 400. По экспериментальным данным были построены кинетические зависимости концентрации ионов Hg2+ в исследуемом растворе от времени ионного обмена катионов для V/m = 100 при гранулометрическом составе ЖМК от 0,63 до 1,00 мм, скорости перемешивания 400 об· мин-1 и при температурах 288, 303, 323 К. Результаты эксперимента представлены на рисунке 1.
Обработка кинетических данных процесса ионного обмена катионов при использовании уравнения реакции первого порядка (С0, Сф — начальная и текущая концентрации катиона Hg2+, k-константа скорости процесса ионного обмена, фвремя процесса ионного обмена) привела к прямолинейной зависимости в интервале времени ф = 2 15 мин для температур 288 и 303 К и в интервале времени ф = 1 10 мин для 323 К.
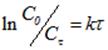
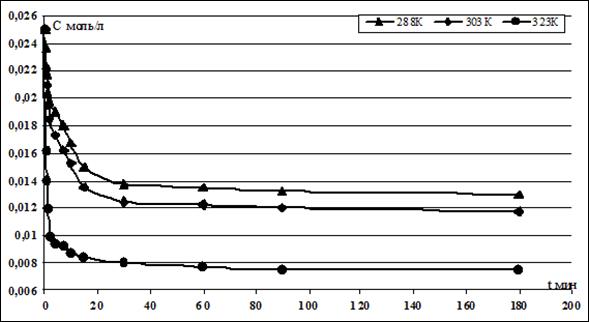
Рисунок 1. Экспериментальная зависимость концентрации Hg2+ от времени процесса ионного обмена при температурах 288, 303, 323 К, V/m = 100 для ЖМК грансостава -1,0+0,63 мм и скорости перемешивания 400 обмин-1
При времени ионного обмена катионов менее 2 минут процесс протекал с большой скоростью в нестационарном режиме. В начальный момент времени, когда ЖМК вносили в раствор, концентрация Hg2+ на их поверхности CS = 0, и градиент концентрации в слое Нернста максимален. Затем, с ростом CS, скорость диффузии и скорость процесса ионного обмена выравниваются, и устанавливается постоянный градиент концентрации. Процесс переходит в стационарный режим. Поэтому при обработке результатов для температур 288 и 303К за исходную принимали концентрацию Hg2+ при ф = 2 мин. При времени сорбции более 15 минут процесс вновь переходит в нестационарный режим, так как поверхностная концентрация CS выходит на равновесное значение, и градиент концентрации в слое Нернста начинает уменьшаться. Так как с ростом температуры скорость реакции возрастает, при 323 К соответствующим стационарному режиму принимали временной отрезок ф от 1 до 10 мин.
Были получены линейные зависимости величины от времени процесса ионного обмена ф в секундах, приведенные на рисунке 2.
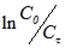
По тангенсу угла наклона были найдены величины констант скорости процесса ионообменной сорбции k, приведенные в таблице 1.
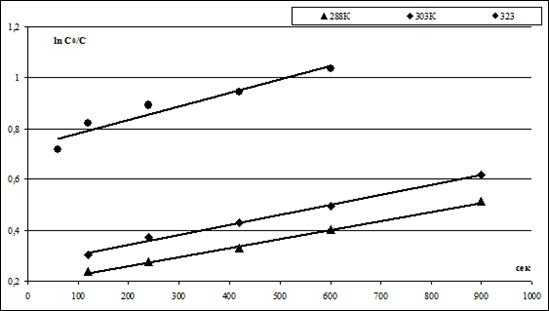
Рисунок 2. Зависимости величины от времени процесса ионного обмена в интервале времени ф = 1 15 мин для соотношения V/m = 100 и грансостава ЖМК — 1,0 + 0,63 мм, скорости перемешивания 400 об· мин-1 при 288, 303 и 323К.
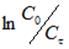
Таблица 1.
Константы скорости ионного обмена катионов Hg2+ и Na+ на ЖМК при температурах 288, 303, 323К.
V/mмл/г. | Гранулометрический состав ЖМК, мм. | Число оборотов мешалки, обмин-1 | Температура процесса, К. | Константа скорости внешней диффузии k, с-1 |
— 1,00+0,63. | 3,5410-4 | |||
3,910-4 | ||||
5,2710-4 |
В диапазоне ф > 15 мин были рассчитаны зависимости величины степени извлечения F, равной, где С0, Сф, С — начальная, текущая и равновесная концентрации катиона Hg2+, от квадратного корня из времени процесса ионного обмена, которые оказались непрямолинейными. Следовательно, интервалу времени ф > 15 мин. соответствует промежуточная кинетическая область, определяемая соотношением скоростей внешней и внутренней диффузии катионов Hg2+.Для подтверждения вывода о внешнедиффузионном механизме процесса провели ионный обмен при соотношении объема жидкой фазы V (мл) к массе твердого образца m (г) V/m = 400 и гранулометрическом составе ЖМК — 1,0+0,63 мм при температуре 303 К и скорости перемешивания 400 об· мин-1.Кинетические зависимости концентрации катионов Hg2+ в исследуемом растворе от времени процесса ионного обмена аналогично интерпретировали уравнениями первого порядка. В диапазоне ф = 2 15 мин при 303 К и скорости перемешивания 400 об· мин-1 были получены линейные зависимости величины от времени процесса ионного обмена ф, рисунок 3.
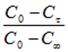
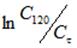
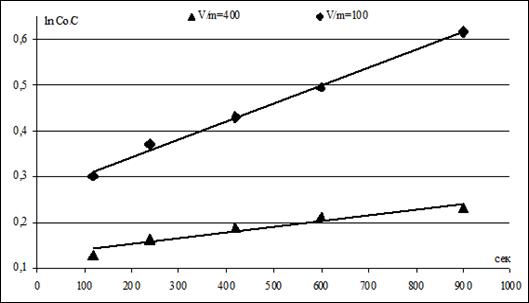
Рисунок 3. Зависимость величины от времени процесса ионного обмена в интервале времени ф = 2−15 мин для соотношений V/m 100 и 400 при скорости перемешивания 400 об· мин-1 и температуре 303К.
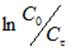
железомарганцевый ионообменный сорбция катион ртуть Константы скорости процесса ионного обмена катионов Hg2+ и Na+ на ЖМК в зависимости от соотношения V/m приведены в таблице 2.
Таблица 2
Константы скорости ионообменной сорбции катионов, энергия активации, радиусы катионов по Стоксу и Бокию.
Катион. | k c-1 | Еа, кДж/моль. | по Стоксу, пм. | по Бокию [2], пм. |
Ni2+ [8]. | 1,710-3 | 7,43. | ||
Mn2+ [11]. | 0,93· 10-3 | 7,15. | ||
Hg2+ | 3,910-4 | 9,27. | ||
Pb2+ [10]. | 9,910-5 | 14,64. |
Как видно из таблицы 2, константа скорости внешней диффузии k возрастает с уменьшением соотношения V/m, так как возрастает отношение S/V. Этим подтверждается внешнедиффузионный механизм процесса.
Значение энергии активации определяли, используя логарифмическое уравнение Аррениуса:
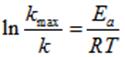
Согласно уравнению и определенным значениям констант скорости построили графическую зависимость логарифма величины константы скорости процесса от величины, обратной температуры:, которая является прямолинейной, рисунок 4.
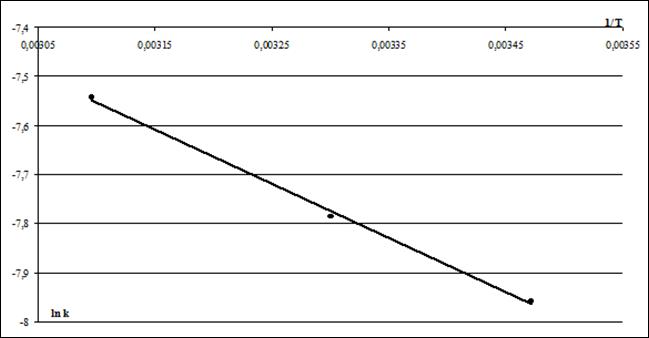
Рисунок 4. Зависимости логарифма величины константы скорости от величины обратной температуры процесса.
По угловому коэффициенту рассчитали значение энергии активации и уравнения Аррениуса, которое составило. Низкое значение энергии активации согласуется с тем, что лимитирующей стадией процесса является внешняя диффузия. В таблице 2 сопоставлены значения полученных нами кинетических параметров с имеющимися в литературе аналогами. Там же приведены кристаллографические радиусы по Бокию [2] и радиусы гидратированных катионов, рассчитанные по формуле Стокса:
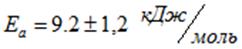
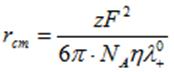
Катионы по скорости стационарной диффузии располагаются в следующий ряд подвижности:
Pb2+ < Hg2+ < Mn2+ < Ni2+
В ряду подвижности увеличивается константа скорости и уменьшается энергия активации диффузии. При этом возрастают значения радиусов катионов по Стоксу, что противоречит представлению о диффузии катионов в слое Нернста в гидратированном состоянии. Радиусы катионов по Бокию, напротив, в ряду подвижности уменьшаются.
Как в случае с катионами Pb2+, описанном в [10], понижение скорости диффузии при переходе к катионам Hg2+ и далее к катионам Ni2+ [8] нельзя объяснить и увеличением массы частиц, так как согласно уравнению Стокса-Эйнштейна коэффициент диффузии определяется не массой, а размером частиц. Обращает внимание уменьшение кристаллографического радиуса в ряду подвижности при переходе от катионов Pb2+ к катионам Hg2+ и далее к катионам Ni2+.
Это подтверждает сделанное предположение, согласно которому катионы при диффузии в неподвижном приповерхностном слое раствора передвигаются отдельно от гидратной оболочки, «перескакивая» от одной группы неподвижно закрепленных молекул воды к другой. Их гидратная оболочка при этом последовательно обновляется. Поэтому основным фактором, определяющим скорость и энергию активации диффузии является кристаллографический радиус катиона.
Выводы:
- 1. Показано, что кинетика ионного обмена катионов Hg2+ и Na+ подчиняется уравнению первого порядка. Значение энергии активации Ea составило 9,2±1,2 кДж· моль-1 соответственно. Рассчитаны значения констант скорости внешней диффузии катионов k в зависимости от температуры процесса и размера гранул ЖМК.
- 2. Низкое значение энергии активации и зависимость константы скорости от гранулометрического состава подтверждает то, что лимитирующей стадией процесса является внешняя диффузия.
- 3. Катионы металлов располагаются в следующий ряд подвижности:
Pb2+ | < Hg2+ | < Mn2+ | < Ni2+ | |
Еа, кДж/моль. | 14,64. | 9,27. | 7,43. | 7,15. |
k, c-1 | 9,910-5 | 3,910-4 | 0,93· 10-3 | 1,710-3 |
В ряду повышается константа скорости внешней диффузии и понижается энергия активации. Ряд подвижности коррелирует с уменьшением кристаллографических радиусов катионов и не согласуется с ростом вдоль него радиусов катионов по Стоксу, что объясняется «проскоковым» механизмом диффузии.
Библиографический список
- 1. Челищев Н. Ф., Грибанов Н. К., Новиков Г. В. Сорбционные свойства океанических железомарганцевых конкреций и корок // М.: Недра. 1992. С. 7−23, 316.
- 2. Краткий справочник физико-химических величин./ Под ред. А. А. Равделя и А. М. Пономаревой. Л.: Химия. 2002. С. 123, 130, 200. 232 231 с.
- 3. Челищев Н. Ф., Грибанова Н. К., Новиков Г. В. // Обогащение руд. 1988. № 3. С. 32−34.
- 4. Зарицкий В. П. // Конкреции и конкреционный анализ: Сб. статей. М.: Наука, 1977. С 84−89, 245 с.
- 5. Новиков Г. В., Сироткина И. В. / Сорбционный механизм формирования химического состава океанских железомарганцевых рудных отложений. Журнал «Вестник Отделения наук о Земле РАН» № 1(22) 2004 С. 38−42.
- 6. Чиркст Д. Э., Черемисина О. В., Иванов М. В., Чистяков А. А., Жадовский И. Т., /Изотерма обмена катионов стронция и натрия на железомарганцевых конкрециях // ЖПХ. 2006. Т. 79. № 3. С.374−379.
- 7. Чиркст Д. Э., Черемисина О. В., Иванов М. В., Чистяков А. А., Жадовский И. Т., / Изотерма обмена катионов никеля и натрия на поверхности. // ЖМК ЖПХ. 2006. Т. 79. № 7. С.1101−1105.
- 8. Чиркст Д. Э., Черемисина О. В., Жадовский И. Т., Иванов М. В., Чистяков АА, /Кинетика сорбции катионов никеля на поверхности ЖМК// Известия вузов. Химия и хим.технология. 2006. Т.49. Вып.11. ст 405−410
- 9. Чиркст Д. Э., Черемисина О. В., Иванов М. И., Чистяков А.А./ Изотерма СТРОНЦИЯ // ЖПХ. 2005, Т. 78. № 4. С. 599−605
- 10. Д. Э. Чиркст, О. В. Черемисина, А. А. Чистяков, И. Т. Жадовский / Кинетика ионного обмена катионов свинца и натрия на поверхности железомарганцевых конкреций // Журнал прикладной химии. 2010. Т. 83. Вып. 9. С.1440−1443
- 11. Березюк В. Г., Евтюхова О. В., Макурин Ю. Н. // В сб. «Научные исследования по экологии и рациональному природопользованию». СПб.: изд. СПГГИ (ТУ), 2000, С. 88−90.