Интересные факты.
Водородная связь

Вторичная структура ДНК образуется за счет взаимодействий нуклеотидов (в большей степени азотистых оснований) между собой, водородных связей. Классический пример вторичной структуры ДНК — двойная спираль ДНК. Двойная спираль ДНК — самая распространенная в природе форма ДНК, состоящая из двух полинуклеотидных цепей ДНК. Построение каждой новой цепи ДНК осуществляется по принципу комплементарности… Читать ещё >
Интересные факты. Водородная связь (реферат, курсовая, диплом, контрольная)
1. Горячая вода замерзает быстрее, чем холодная.
Если поместить в морозилку две одинаковые колбы, одну с горячей, а другую с холодной водой, то колба с горячей водой замёрзнет быстрее, чем с холодной. Хотя это, вроде бы и противоречит здравому смыслу. Этот факт впервые установил опытным путём ученик старших классов Эрасто Б. Мпемба в 1963 году. Поэтому этот феномен носит название «эффект Мпемба». Учёные до сих пор не могут выяснить причину этого явления.
- 2. «Сверхохлаждение» предотвращает формирование льда. Вода, как известно, превращается в лёд при охлаждении до температуры, ниже 0 градусов цельсия. Но обыкновенная вода обладает удивительным свойством «сверхохлаждения» ! Это явление приводит к тому, что вода даже охлаждённая до температуры ниже 0 градусов может оставаться жидкой. Это наблюдается в тех случаях, когда окружающая среда не содержит центров или ядер кристаллизации, которые могли бы спровоцировать образование кристаллов льда. Когда же процесс кристаллизации запускается, можно наблюдать, как «сверхохлажденная» вода мгновенно превращается в лед.
- 3. Вода может быть «стеклянной» В каких состояниях может находиться вода? Твёрдом, жидком и газообразном? А вот и нет. Ученые выделяют по меньшей мере пять состояний «жидкой» воды и целых четырнадцать состояний льда. Так вот, что бы вы ни делали, при температуре -38 °C самая сверхохлажденная вода внезапно превратится в лед. А при -120 °C лед становится тягучим, как патока, при -135 °C и ниже он превращается в «стеклянную» или «стекловидную» воду — твердое вещество с отсутствием кристаллов.
- 4. Память воды. Считается, что вода способна «запоминать» свойства жидкостей, растворённых в ней, даже если коэффициент разбавления настолько велик, что в растворе уже не остается ничего, кроме молекул воды. Этот факт попыталась подтвердить международная группа ученых во главе с профессором Мэдлин Эннис из Королевского университета Белфаста, в 2002 году. По итогам исследований было заявлено, что эффект «памяти воды» действительно существует. Однако опыты, проведенные позже под наблюдением независимых экспертов, не дали результатов. Тем не менее этот феномен изучается до сих пор.
- 5. Квантовое число воды Оказывается, что на молекулярном уровне, на уровне аттосекунд (время, за которое свет проходит расстояние, сравнимое с размерами молекулы воды) с водой происходит необычайный квантовый эффект и химическая формула воды из обыденной Н2О превращается в Н15О! Этот феномен был установлен в 1995 году в результате эксперимента.
Самое удивительное в структуре воды заключается в том, что молекулы воды при низких отрицательных температурах и высоких давлениях внутри нанотрубок могут кристаллизоваться в форме двойной спирали, напоминающую ДНК. Это было доказано компьютерными экспериментами американских учёных под руководством Сяо Чэн Цзэна в Университете штата Небраска (США).
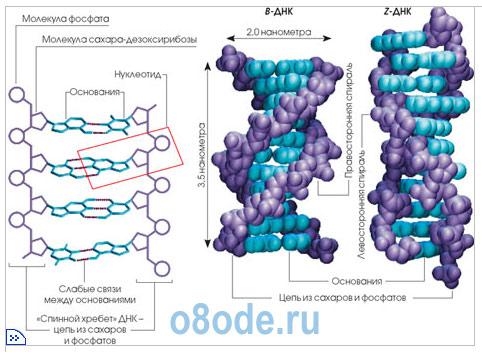
ДНК представляет собой двойную цепочку, скрученную в спираль. Каждая нить состоит из «кирпичиков» — из последовательно соединенных нуклеотидов. Каждый нуклеотид ДНК содержит одно из четырёх азотистых оснований — гуанин (G), аденин (A) (пурины), тимин (T) и цитозин © (пиримидины), связанное с дезоксирибозой, к последней, в свою очередь, присоединена фосфатная группа. Между собой соседние нуклеотиды соединены в цепи фосфодиэфирной связью, образованной 3'-гидроксильной (3'-ОН) и 5'-фосфатной группами (5'-РО3). Это свойство обуславливает наличие полярности в ДНК, т. е. противоположной направленности, а именно 5'- и 3'-концов: 5'-концу одной нити соответствует 3'-конец второй нити. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, наиболее важными из которых являются информационные, или матричные (мРНК), рибосомальные (рРНК) и транспортные (тРНК). Все эти типы РНК синтезируются на матрице ДНК за счёт копирования последовательности ДНК в последовательность РНК, синтезируемой в процессе транскрипции и принимают участие в важнейшем процессе жизни — передачи и копирования информации (трансляции).
Первичная структура ДНК — это линейная последовательность нуклеотидов ДНК в цепи. Последовательность нуклеотидов в цепи ДНК записывают в виде буквенной формулы ДНК: например — AGTCATGCCAG, запись ведется с 5'- на 3'-конец цепи ДНК.
Вторичная структура ДНК образуется за счет взаимодействий нуклеотидов (в большей степени азотистых оснований) между собой, водородных связей. Классический пример вторичной структуры ДНК — двойная спираль ДНК. Двойная спираль ДНК — самая распространенная в природе форма ДНК, состоящая из двух полинуклеотидных цепей ДНК. Построение каждой новой цепи ДНК осуществляется по принципу комплементарности, т. е. каждому азотистому основанию одной цепи ДНК соответствует строго определенное основание другой цепи: в комплемнтарной паре напротив A стоит T, а напротив G располагается C и т. д.
Чтобы вода сформировала спираль, наподобие, в моделируемом эксперименте она «помещалась» в нанотрубки под высоким давлением, варьирующимися в разных опытах от 10 до 40 000 атмосфер. После этого задавали температуру, которая имела значение -23°C. Запас по сравнению с температурой замерзания воды делался в связи с тем, что с повышением давления температура плавления водяного льда понижается. Диаметр нанотрубок составлял от 1,35 до 1,90 нм.
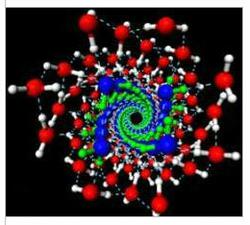
Рис. Общий вид структуры воды (изображение New Scientist)
Молекулы воды связываются между собой посредством водородных связей, расстояние между атомами кислорода и водорода равно 96 пм, а между двумя водородами — 150 пм. В твёрдом состоянии атом кислорода участвует в образовании двух водородных связей с соседними молекулами воды. При этом отдельные молекулы H2O соприкасаются друг с другом разноимёнными полюсами. Таким образом, образуются слои, в которых каждая молекула связана с тремя молекулами своего слоя и одной из соседнего. В результате, кристаллическая структура льда состоит из шестигранных «трубок» соединенных между собой, как пчелиные соты.

Рис. Внутренняя стенка структуры воды (изображение New Scientist)
Учёные ожидали увидеть, что вода во всех случаях образует тонкую трубчатую структуру. Однако, модель показала, что при диаметре трубки в 1,35 нм и давлении в 40 000 атмосфер водородные связи искривились, приведя к образованию спирали с двойной стенкой. Внутренняя стенка этой структуры является скрученной в четверо спиралью, а внешняя состоит из четырёх двойных спиралей, похожих на структуру молекулы ДНК.
Последний факт накладывает отпечаток не только на эволюцию наших представлений о воде, но и эволюцию ранней жизни и самой молекулы ДНК. Если предположить, что в эпоху зарождения жизни криолитные глинистые породы имели форму нанотрубок, возникает вопрос — не могла ли вода, сорбированная в них служить структурной основой (матрицей) для синтеза ДНК и считывания информации? Возможно, поэтому спиральная структура ДНК повторяет спиральную структуру воды в нанотрубках.
Лёд — кристаллическая модификация воды. По последним данным лёд имеет 14 структурных модификаций. Среди них есть и кристаллические (их большинство) и аморфные модификации, но все они отличаются друг от друга взаимным расположением молекул воды и свойствами. Правда, все, кроме привычного нам льда, кристаллизующего в гексагональной сингонии, образуются в условиях экзотических — при очень низких температурах и высоких давлениях, когда углы водородных связей в молекуле воды изменяются и образуются системы, отличные от гексагональной. Такие условия напоминают космические и не встречаются на Земле. Например, при температуре ниже -110 °С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров — это так называемый кубический лед. Если температура чуть выше -110 °С, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда.
Самое необычное свойство льда — это удивительное многообразие внешних проявлений. При одной и той же кристаллической структуре он может выглядеть совершенно по-разному, принимая форму прозрачных градин и сосулек, хлопьев пушистого снега, плотной блестящей корки льда или гигантских ледниковых масс.
Природный лёд обычно значительно чище, чем вода, так как при кристаллизации воды в первую очередь в решётку встают молекулы воды, а примеси вытесняются в жидкость.
Лёд может содержать механические примеси — твёрдые частицы, капельки концентрированных растворов, пузырьки газа. Наличием кристалликов соли и капелек рассола объясняется солоноватость морского льда.
Растущий кристалл льда всегда стремится создать идеальную кристаллическую решетку и вытесняет посторонние вещества. Но в планетарном масштабе именно замечательный феномен замерзания и таяния воды играет роль гигантского очистительного процесса — вода на Земле постоянно очищает сама себя.
Общие запасы льда на Земле около 30 млн. км3. Больше всего льда сосредоточено в Антарктиде, где толщина его слоя достигает 4 км. Также имеются данные о наличии льда на планетах Солнечной системы и в кометах.