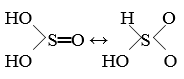Сернистая кислота — H2SO3
H2SO3 — кислота средней силы:
H2SO3+H2O-H3O++HSO-3 К 1=2•10-2.
HSO-3+H2O-H3O-H3O++SO2-3 К 2=6•10-8.
Для H2SO3 возможны две структуры:
Известна лишь в водных растворах [8]. Растворы ее сильно пахнут диоксидом серы, т. е. значительная часть газа остается несвязанной. Нагреванием раствора можно полностью освободится от SO2, останется чистая Н2О.
Соответствует 2 ряда солей: нормальные — сульфиты, и кислые — гидросульфиты:
H2SO3+2NaOH=Na2SO3+2H2O,.
H2SO3+NaOH=NaHSO3+H2O.
Гидросульфиты за исключением известных в кристаллическом состоянии МНSO3(M=Na, K, Rb, Cs) устойчивы лишь в растворах, им отвечает вторая из приведенных структур H2SO3.
Сульфиты могут быть выделены; большинству этих солей отвечает первая структура (исключение составляют соли некоторых малорастворимых Ме).
Химические свойства H2SO3 и сульфитов определяются наличием неполностью окисленного атома серы. В них S окислена до состояния +4, максимальна же возможная степень окисления +6, а минимальная -2. Они могут быть как восстановителями, так и окислителями. Для H2SO3 наиболее характерны восстановительные свойства, поэтому растворы ее, а также сухие соли следует хранить в хорошо закрытой посуде во избежание окисления кислородом воздуха.
H2SO3+O2=2H2SO4,.
2NaSO3+O2=2Na2SO4.
При взаимодействии с бромной водой H2SO3 окисляется до H2SO4:
H2O+H2SO3+Br2=2HBr+H2SO4.
При взаимодействии с активными восстановителями выступает в роли окислителя:
2H2S+H2SO4=3S+3H2O.
H2SO3 — дезинфицирующее вещество, которое применяется для обеззараживания погребов, подвалов, для консервирования овощей и фруктов. Сульфиты также используют для консервирования мяса и мясных продуктов, крови, бульонов, предназначенных для выработки фотографического желатина, а также для консервирования животного клея.
Na2SO3 используют как составную часть фотографических проявителей [4, 6].
Фторосульфиновая кислота — Н2S2O2F
Н 2S2O2F-НF(ж.)+SO2(ж).
Температура плавления — 84 °C. Наиболее известны соли общей формулы MSO2F (M=Na — Cs), мягкие фторагенты [2].