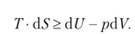Классическое введение энтропии как термодинамической функции

Для общего случая обратимых и необратимых процессов можно объединить предыдущее соотношение с соотношением (3.4): Это уравнение служит аналитическим выражением объединенного первого и второго законов для обратимых процессов. Работа будет максимальной, когда процесс обратим. Отношение A/Аmах < 1 может служить мерой необратимости процесса. Изменение энтропии при бесконечно малом изменении… Читать ещё >
Классическое введение энтропии как термодинамической функции (реферат, курсовая, диплом, контрольная)
Исторически энтропия вводилась другим способом. В средине XIX в. Ю. И. Клаузиус показал, что существует такая термодинамическая функция, которая является функцией состояния и изменение которой для обратимого изотермического перехода теплоты равно приведенной теплоте процесса.
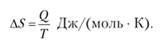 (3.3).
(3.3).
Эта величина получила название энтропии.
Обратимые процессы протекают последовательно через ряд состояний равновесия. Для обратимого перехода бесконечно малого количества теплоты предыдущее выражение можно записать в следующем виде:
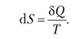 (3.4).
(3.4).
с!5 здесь является полным дифференциалом. Энтропия является функцией состояния, и ее изменение не зависит от пути перехода из начального состояния в конечное.
Обратимся к первому началу термодинамики:
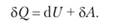
Разделив это выражение на T, получим для обратимых процессов.
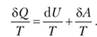
Отсюда, зная что 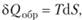 , получим.
, получим.
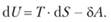 (3.5).
(3.5).
Это уравнение служит аналитическим выражением объединенного первого и второго законов для обратимых процессов.
Из уравнения 3.5 следует, что не все изменение запаса внутренней энергии при постоянной температуре превращается в работу, а только его часть. Слагаемое этого уравнения TdS отображает ту часть внутренней энергии, которая не переходит в работу, его называют связанной энергией.
Если работа производится идеальным газом против внешнего давления, то  При этом предыдущее выражение для объединенного первого и второго законов термодинамики предстанет в виде.
При этом предыдущее выражение для объединенного первого и второго законов термодинамики предстанет в виде.
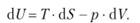 (3.6).
(3.6).
Так как dU и dS являются полными дифференциалами, то и 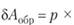 dV здесь не зависит от пути.
dV здесь не зависит от пути.
Изменение энтропии в фазовых переходах Д5ф «можно представить как.
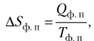
где Qф |1 и Tф «— соответственно теплота и температура фазового перехода.
Изменение энтропии при бесконечно малом изменении температуры вещества можно представить как.
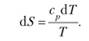
Изменение энтропии как критерий самопроизвольного протекания процесса в изолированной системе
Самопроизвольные процессы идут без затраты энергии извне. Самопроизвольное течение процесса связано с необратимостью. Необратимыми в термодинамическом смысле называются такие процессы, после протекания которых систему уже нельзя вернуть в начальное состояние без того, чтобы не осталось каких-нибудь изменений в ней самой или в окружающей среде (например, переход теплоты от более горячего тела к более холодному).
Для необратимого процесса.

Для общего случая обратимых и необратимых процессов можно объединить предыдущее соотношение с соотношением (3.4):
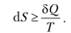
В адиабатических (или адиабатных) процессах (т.е. когда SQ = 0).
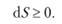
То есть в любых изолированных системах (в них могут совершаться только адиабатические процессы) энтропия системы постоянна при обратимых процессах и возрастает при необратимом процессе. В химии адиабатными могут считаться процессы с нулевыми тепловыми эффектами (ДH = 0; ДU = 0).
Процесс протекает самопроизвольно, пока система не перейдет в равновесное состояние, в котором энтропия максимальна. При устойчивом равновесии должно соблюдаться два условия, определяющих условия максимума энтропии:
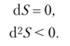
В общем случае объединенный первый и второй законы термодинамики можно записать так:
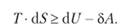
В этих уравнениях dU и dS не зависят от обратимости или необратимости процесса (так как U и S — функции состояния), но работа ?A зависит.
Работа будет максимальной, когда процесс обратим. Отношение A/Аmах < 1 может служить мерой необратимости процесса.
Если работа производится только против внешнего давления (или получается за счет него), то ?A = р • dV. При этом предыдущее выражение для объединенного первого и второго законов термодинамики предстанет в виде.