Второй закон термодинамики

Энтропия 1 моль вещества в стандартном состоянии называется стандартной энтропией (5°, ДжДмоль-К). Изменение стандартной энтропии в химической реакции, аналогично изменению энтальпии, можно определить по уравнению. Имеет меньшие значения в ковалентно связанных твердых веществах с прочными, пространственно направленными связями, по сравнению с кристаллами с частично металлической связью; Постулат… Читать ещё >
Второй закон термодинамики (реферат, курсовая, диплом, контрольная)
Второй закон термодинамики является физическим принципом, накладывающим ограничение на направление процессов передачи тепла между телами.
Согласно этому закону невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому (одна из первых формулировок закона; М. В. Ломоносов, 1850 г.).
Существует несколько эквивалентных формулировок второго закона термодинамики, среди которых:
- • постулат Клаузиусаи. «Невозможно осуществить перенос тепла от более холодного тела к более горячему без затраты работы»;
- • постулат Томсона[1][2]: «Невозможно превратить какое-либо количество теплоты полностью в работу без того, чтобы часть теплоты не оказалась растраченной при более низкой температуре».
Энтропия (5) — важная функция состояния термодинамической системы. Энтропию можно охарактеризовать как меру хаотичности или неупорядоченности системы.
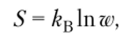
где w — число возможных микросостояний системы; kB — постоянная Больцмана, равная отношению R/NA = 1,381 • 10 Дж/К; R — универсальная газовая постоянная, равная 8,315 ДжДмоль — К); NA — постоянная Авогадро, равная 6,022−1023 моль-1.
При абсолютном нуле (Т = 0 К) энтропия идеального кристалла равна нулю — полная упорядоченность, w = 1 (иногда это положение называют нулевым законом термодинамики).
Изменение энтропии (5) равно теплоте, подведенной к системе в обратимом изотермическом процессе, деленной на абсолютную температуру, при которой осуществляется этот процесс (Клаузиус, 1865): AS = Q/T. Для необратимого процесса при температуре Т: AS > QJT.
В соответствии с изменением числа возможных микросостояний системы энтропия:
- • возрастает при превращении жидкости или твердого тела в газ;
- • увеличивается при растворении твердого вещества или жидкости в воде или в другом растворителе;
- • уменьшается при растворении газа в воде или в другом растворителе;
- • возрастает при увеличении числа частиц в системе;
- • имеет меньшие значения в ковалентно связанных твердых веществах с прочными, пространственно направленными связями, по сравнению с кристаллами с частично металлической связью;
- • повышается по мере ослабления связей между атомами.
На рис. 4.6 приведена типичная кривая изменения значений энтропии для вещества в широком диапазоне температур, в котором это вещество переходит из твердого кристаллического состояния в жидкое и далее из жидкого состояния в газообразное.
Повышение температуры сопровождается ростом энтропии, которая вплоть до достижения температуры плавления кристаллического вещества (Гпл) изменяется по плавной кривой ОА (см. рис. 4.6). В точке плавления нарушается дальний порядок во взаимном расположении частиц, и энтропия скачкообразно возрастает на AS (отрезок ЛВ). Повышение температуры выше точки плавления вещества вызывает последовательное увеличение энтропии жидкости, которое происходит по плавной кривой ВС вплоть до достижения температуры кипения (ГКШ1). В этой точке жидкость полностью превращается в пар, и энтропия скачком возрастает на величину Д5пар, соответствующую отрезку CD. Далее энтропия газа изменяется по плавной кривой DE, и новое скачкообразное возрастание энтропии может произойти только в результате химических изменений газа (термической диссоциации, ионизации и т. п.), приводящих к увеличению числа частиц и росту беспорядка в системе.
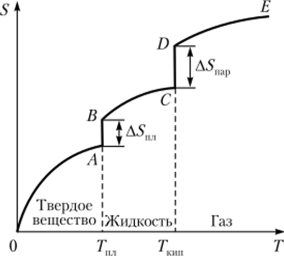
Рис. 4.6. Типичная зависимость энтропии вещества от температуры.
Энтропия 1 моль вещества в стандартном состоянии называется стандартной энтропией (5°, ДжДмоль-К). Изменение стандартной энтропии в химической реакции, аналогично изменению энтальпии, можно определить по уравнению.
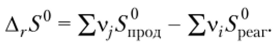
Пример 4.5. Рассчитаем изменение энтропии при получении сульфата цинка путем обжига сульфида цинка (сфалерита).
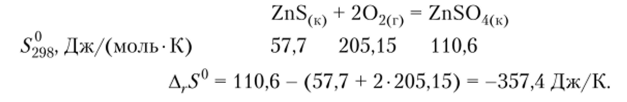
Значения стандартной молярной энтропии различных веществ при 298 К сведены в таблицы и имеются в справочной литературе (см. также приложение 2). Стандартная молярная энтропия простого вещества не равна нулю. Стандартная молярная энтропия сложного вещества возрастает при увеличении числа атомов в молекуле.