Основы проектирования искусственных органов и систем жизнеобеспечения

По данным обращаемости за медицинской помощью в Российской Федерации, в 1993;1996 гг. зарегистрировано около 2 млн больных сахарным диабетом, из которых примерно 300 тыс. приходится на больных, страдающих СД 1, и приблизительно 1 млн 700 тыс. — на больных с СД 2. В 1997 г. общее количество больных сахарным диабетом увеличилось на 200 тыс. (по данным обращаемости) в основном за счет больных… Читать ещё >
Основы проектирования искусственных органов и систем жизнеобеспечения (реферат, курсовая, диплом, контрольная)
При искусственном жизнеобеспечении нормальное состояние организма может поддерживаться с помощью биоискусственных органов, искусственных органов и их комбинаций. Пример биоискусственного органа — искусственная поджелудочная железа, которая осуществляет инфузию инсулина при диабете. Пример искусственного органа — искусственная почка.
Сопоставление методов искусственного жизнеобеспечения показывает, что оно основано на экстраши интракорпоральном управляющем воздействии (непосредственно ши через мембрану) на биологическую среду специальных управляющих сред (вещественных, энергетических, информационных ши их комбинаций).
Экстракорпоральное управляющее воздействие на кровь осуществляется вне организма, интракорпоральное — в естественных органах, составляющих организм ши выполняющих функцию исполнительного процессора в биоискусственных органах.
Принципы проектирования БТС для регулирования гликемии
Определение целевого назначения и класса проектируемой БТС. В каждом биоискусственном органе исполнительным процессором является соответствующий естественный орган, а управляющим процессором — техническое средство (табл. 15.1). Для управления гликемией применяют различные методы введения в кровь инсулина. Актуальная задача медицины — терапия патологии метаболизма углеводов с одновременной патологией липидного метаболизма. Это обусловлено резким ростом числа диабетических пациентов с признаками ожирения. Таким образом, регуляция концентрации глюкозы в крови (КГК, или гликемии) у больных сахарным диабетом — одна из важных проблем современной медицины. В настоящее время для решения этой проблемы все больше используют такие технические средства, как переносные электронные дозаторы инсулина и стационарные микрокомпьютерные аппараты типа «Искусственная бета-клетка».
Таблица 15.1. Искусственные системы жизнеобеспечения.
Метод. | Процессор | ||
искусственного жизнеобеспечения. | исполнительный. (естественный орган). | управляющий. (техническое средство). | Управляющая среда. |
Кардиостимуляция. | Сердце. | Кардиостимулятор (КС). | Информационная. |
Дефибрилляция. | То же. | Дефибриллятор | Энергетическая. (электрическая энергия). |
Искусственная вентиляция легких. | Легкие. | Аппарат ИВЛ (АИВЛ). | Вещественная. (кислород). |
Терморегулирование. | Кожа. | Терморегулирующее устройство (ТРУ). | Энергетическая (тепловая энергия). |
Инфузия инсулина. | Распределитель кровотока. | Искусственная поджелудочная железа. | Вещественная. (инсулин). |
Искусственное питание Диализ: | Органы пищеварения. | Аппарат искусственного питания (АИП). | То же. (вода и питательные вещества). |
кишечный. | Кишечник. | Аппарат кишечного диализа (АКД). | Вещественно-энергетическая (нестерильный диализат). |
перитонеальный. | Брюшная полость (БШ). | Аппарат перитонеального диализа (АПД). | То же (стерильный диализат). |
И глоукалы вание. | Органы нервной системы (ОНС). | Аппарат иглоукалывания (АИУ). | Информационная. |
Создание БТС для регулирования гликемии, обеспечивающей снижение аномально повышенной концентрации глюкозы в крови до физиологической нормы и ее поддержку в течение необходимого времени в заданных пределах, связано с разработкой алгоритмов управления, средств программного и аппаратного обеспечения. Поэтому перспективным является расширение функций терапевтического аппарата. «Искусственная бета-клетка», направленных на управление уровнем свободных жирных кислот в крови.
Особенно актуально расширение функций автоматизированных терапевтических аппаратов «Искусственная бета-клетка» за счет оснащения их экспертно-консультативной системой на основе персонального компьютера. Такая задача обусловлена необходимостью использования при принятии терапевтических решений дополнительной информации об управляемых патологических процессах у широкого контингента пациентов. Для этого требуется система мониторинга процессов метаболизма циркадного характера с фиксацией терапевтических воздействий, диеты, физических и эмоционально-психических нагрузок. Результаты мониторинга должны заноситься в базу данных и служить исходной информацией для экспертно-консультативной системы. Решения, принимаемые с помощью такой системы, должны повышать эффективность функционирования терапевтического аппарата.
Цель проектирования данной БТС — жизнеобеспечение больных с недостаточностью органов, приводящей к гипергликемии. Следовательно, аппараты регулирования гликемии (АРГ) при сахарном диабете можно отнести к классу искусственных (протезных) органов и систем жизнеобеспечения (рис. 15.1).
Создание базы данных о свойствах биообъекта. Вербальная модель. Как уже было отмечено, сахарный диабет — одна из актуальных проблем здравоохранения. Количество больных диабетом увеличивается во всех странах и, по данным Всемирной организации здравоохранения (ВОЗ), в настоящее время в мире насчитывается более 150 млн больных. Расчеты экспертов ВОЗ показывают, что к 2010 г. количество больных сахарным диабетом в мире достигнет 230 млн человек.
У больных сахарным диабетом типа 1 (СД 1) гипергликемия возникает вследствие абсолютной недостаточности инсулина, а у больных диабетом типа 2 (СД 2) — в результате развития тканевой резистентности к инсулину и нарушения физиологических механизмов регуляции его секреции.

Рис. 15.1. Классификация искусственных органов и систем жизнеобеспечения.
По данным обращаемости за медицинской помощью в Российской Федерации, в 1993;1996 гг. зарегистрировано около 2 млн больных сахарным диабетом, из которых примерно 300 тыс. приходится на больных, страдающих СД 1, и приблизительно 1 млн 700 тыс. — на больных с СД 2. В 1997 г. общее количество больных сахарным диабетом увеличилось на 200 тыс. (по данным обращаемости) в основном за счет больных, страдающих СД 2. Однако истинное количество заболевших сахарным диабетом значительно выше и, по полученным расчетам, должно составлять 6…8 млн человек. Эти данные основаны на проведенных эпидемиологических исследованиях в Москве, Санкт-Петербурге и других городах Российской Федерации.
Большая социальная значимость сахарного диабета состоит в том, что он приводит к ранней инвалидности и летальному исходу, которые обусловлены наличием поздних сосудистых осложнений диабета: микроангиопатии (ретинопатии и нефропатии), макроангиопатии (инфаркта миокарда, инсульта, гангрены нижних конечностей) и нейропатии.
Доказано, что хронические осложнения диабета — следствие постоянно повышенной концентрации глюкозы в крови. Как установили М. Томинага и соавторы, риск развития макрососудистых поражений существенно возрастает уже на стадии преддиабета. Значимость гипергликемии как основного фактора риска возникновения и прогрессирования диабетических осложнений достаточно наглядно подтверждена эпидемиологическими исследованиями.
Высокая распространенность сердечно-сосудистой патологии среди больных сахарным диабетом обусловлена еще и тем, что нарушение углеводного обмена зачастую способствует развитию других метаболических нарушений, являющихся общепризнанными факторами риска таких сердечно-сосудистых поражений, как гиперлипидемия, гипертония, нарушения деятельности свертывающей системы крови, системы фибринолиза. Сочетание этих факторов в 2−4 раза увеличивает риск возникновения сердечнососудистых поражений у больных диабетом.
Наблюдения за пациентами с СД 2, проведенные за 12 лет в процессе реализации программы «Исследование роли множественного фактора риска» (Multiple Risk Factor Intervention Trial — MRFIT), подтвердило более высокую частоту сердечно-сосудистой патологии среди больных диабетом по сравнению со здоровыми людьми. При этом среди мужчин, страдающих сахарным диабетом, риск смерти от сердечно-сосудистых заболеваний увеличивается в 2−3 раза, а среди женщин — в 5 раз.
Особенно показателен анализ результатов, полученных в ходе исследования эпидемиологии диабетической ретинопатии в штате Висконсин (The Wisconsin Epidemiology Study of Diabetic Retinopathy — WESDR). Установлено, что при повышении уровня гликозилированного гемоглобина всего на 1% по отношению к исходному уровню частота ретинопатии возрастает на 50%, частота протеинурии — на 20%, летальный исход от ишемической болезни сердца — на 10%.
На ранней стадии развития диабета даже незначительное повышение резистентности тканей к инсулину, в частности в печени, вызывает развитие гипергликемии после приема пищи, так называемой постпрандиальной гипергликемии.
Исследования большого клинического материала (под наблюдением находились 95 тыс. человек на протяжении 12,4 лет) показали, что существует отчетливая взаимосвязь между уровнем глюкозы натощак, уровнем постпрандиальной гипергликемии и риском развития сердечно-сосудистой патологии.
Согласно этим исследованиям, уровень глюкозы натощак, равный 6,1 ммоль/л, увеличивает риск возникновения сердечнососудистой патологии в 1,33 раза, а при уровне постпрандиальной гипергликемии, равной 7,8 ммоль/л, — в 1,58 раза.
Из сопоставления влияния уровня гликемии натощак, определяемой по критериям диабетической ассоциации Америки (American Diabetic Association — ADA), и уровня гликемии через 2 ч после нагрузки, устанавливаемого согласно критериям ВОЗ, ясно, что высокая концентрация глюкозы через 2 ч после приема пищи, как правило, коррелирует с повышенным уровнем смертности независимо от показателей гликемии натощак.
Риск смерти от сердечно-сосудистых заболеваний среди больных СД 2 за 3,5 года возрастает в 4,3 раза, если средний уровень гликозилированного гемоглобина превысит 7% по сравнению с теми, у кого данный показатель ниже.
Исследователи пришли к следующему выводу: по своей значимости постпрандиальная гипергликемия, как фактор риска смертности от сердечно-сосудистой патологии, сопоставима с общепризнанными факторами риска — гипертриглицеридемией и гипертонией.
Установлено, что даже развитие бессимптомной гипергликемии после приема пищи достоверно увеличивает риск смерти от ишемической болезни сердца. Это дало возможность отдельным исследователям утверждать, что кратковременные, но повторяющиеся эпизоды повышения концентрации глюкозы крови после приема пищи являются более значимым фактором риска развития кардиоваскулярной патологии, чем гипергликемия натощак.
По современным представлениям патогенез хронических осложнений сахарного диабета рассматривается с позиций теории глюкозотоксичности, согласно которой хронически повышенная концентрация глюкозы крови — ведущий фактор, инициирующий многообразные биохимические и структурные изменения в клетках и тканях. В соответствии с этими представлениями можно выделить три патогенетических механизма.
1. Активация альтернативного пути обмена глюкозы через повышение активности альдозоредуктазы, что приводит к избы;
точному накоплению сорбитола внутри клеток и нарушению их функции.
- 2. Повышение активности процессов неэнзиматического гликозилирования белков, липопротеинов, нарушающее функции клеточных и базальных мембран, изменяющее функциональную активность компонентов сосудистой стенки, в первую очередь клеток эндотелия. В результате происходит нарушение их нормального взаимодействия с клетками крови, способствующее развитию гиперкоагуляционного синдрома и изменению механизмов регуляции сосудистого тонуса, а также вызывающее развитие сердечно-сосудистой патологии.
- 3. Активация протеинкиназы-С (ПК-С), вследствие чего нарушается функция клеток сосудистых стенок и других тканей.
Из перечисленных механизмов неэнзиматическое гликозилирование и накопление сорбитола в клетках являются прямым следствием длительно существующей гипергликемии. В то же время активность ПК-С может существенно меняться даже при возникновении кратковременных, преходящих эпизодов гипергликемии, как это имеет место в начальной фазе развития сахарного диабета, клинически проявляющейся нарушенной толерантностью к глюкозе.
Известно также, что гипергликемия значительно увеличивает предрасположенность к развитию атеросклероза, хотя реальные механизмы возникновения и прогрессирования атеросклеротического процесса у человека известны только отчасти.
Анализ биообъекта, выбор вектора состояния и метода количественного описания биообъекта. Данные о состоянии углеводного обмена в норме и при патологии могут быть рассчитаны по параметрам различных моделей.
Для терапии диабета в любой момент времени реальное значение концентрации глюкозы в крови, определенное медперсоналом и отличающееся от модельного, может быть введено через клавиатуру в блок управления АРГ. Тем самым в АРГ замыкается обратная связь, происходит пересчет данных, поиск новой модельной концентрации глюкозы и выдача значения новой скорости инфузии инсулина (или глюкозы), соответствующего реальному значению концентрации. Это обеспечивает гибкость АРГ — его приспосабливаемость к конкретным случаям гиперили гипогликемии.
В частности, аппарат «Искусственная бета-клетка» контролирует концентрации глюкозы (ci) и инсулина (с2) в крови, концентрации глюкозы (сз) и инсулина (С4) в ВСЖ. Эти величины являются компонентами вектора состояния углеводного обмена.

По изменению вектора состояния можно судить о необходимости введения инсулина пациенту.
Конструирование целевой функции. Аппарат регулирования гликемии при сахарном диабете обеспечивает контроль и регуляцию концентраций глюкозы и инсулина в крови пациента. Аппарат осуществляет ежеминутный расчет скоростей инфузии (введения) препаратов и отображение на экране дисплея значений модельной концентрации глюкозы, текущего времени, скоростей инфузии и количество введенных препаратов.
Целевая функция должна обеспечить постоянство концентраций контролируемых веществ в крови: глюкозы и инсулина. Тогда целевую функцию можно записать следующим образом:
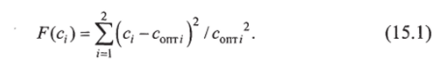
Поскольку необходимо минимизировать разность с, — - с0Пт; концентраций глюкозы в норме и после воздействия, то в конечном виде целевая функция F (c,) имеет вид.
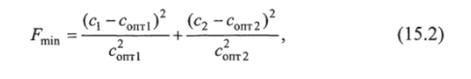
где Fmin — функция с минимально возможными отклонениями от нормы;

где киЬ- коэффициенты линейной регрессии (к = 0,75; b = 105).
Подставляя соотношение (15.3) в (15.2) и принимая во внимание то, что вклад двух концентраций одинаков (т. е. весовые коэффициенты в сумме (15.1) равны единице), получаем зависимость, изображенную на рис. 15.2.
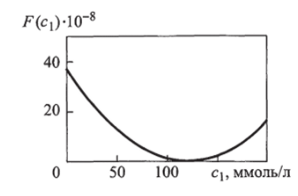
Из приведенной зависимости следует, что функция Fmm очень мала (в пределах 10″ *). Таким образом, целевая функция подтверждает обеспечение посто;
Рис. 15.2. Целевая функция АРГ я.нства концентраций контролируемых веществ с высокой добротностью. В реальных системах Fmm ~ 0,1 …0,01.
Создание физической и математической моделей биообъекта. Специфика управления гликемией с помощью терапевтических аппаратов состоит в том, что оно опирается на количественное описание изменения гликемии под действием инсулина, пищевых и физических нагрузок (см. разд. 9.6).
Эффективное средство такого описания — математические модели. Чтобы описать изменения гликемии математической моделью необходимо построить на основе вербальной модели физическую (компартментную) модель. Эти модели позволяют оценить погрешности редукции (упрощений), а затем свести важные органы в единую систему, отображая процессы математическими зависимостями.
В большинстве моделей за основу берут следующие органы и ткани: сосуды, печень, поджелудочную железу, периферические ткани, межтканевую жидкость. Эти органы и ткани делят на два компартмента (отдела) — сосудистый и внесосудистый, отличающихся своей спецификой и взаимодействующих между собой.
На этой стадии описания перечисленные компартменты отображают с помощью кинетических параметров (констант скорости), количественно описывающих процессы, протекающие в них (см. гл. 5). Эти параметры могут быть постоянными или переменными.
Для описания изменений гликемии при внутривенном тесте на толерантность к глюкозе предложена схема электрической цепи, в которой компартменты представлены емкостями, количества глюкозы в этих компартментах — зарядами на конденсаторах, константы скорости — сопротивлениями. Скорости объемного потока глюкозы между компартментами и ее концентрации аналогичны электрическим токам и напряжениям.
Модель учитывает наличие нескольких компартментов распределения глюкозы в организме: глюкозу в тканях и ее поглощение в зависимости от концентраций глюкозы и инсулина, постоянное поглощение глюкозы мозгом, баланс глюкозы в печени и экскрецию глюкозы почками. Подбором кинетических параметров модели можно получить хорошее описание изменений гликемии и после внутривенной инъекции глюкозы здоровым лицам и пациентам с диабетом. Вычисленные значения резистентности ткани к инсулину и чувствительности печени к глюкозе различны для разных клинических групп пациентов.
Модель Каримова. В исходной модели Н. С. Каримова представлен алгоритм управления, в котором снижение гликемии до нормы не обеспечивало последующее поддержание концентрации глюкозы в установленных пределах. Кроме того, серия экспериментов, проведенных на собаках, показала, что в большинстве случаев эффект введения инсулина проявляется через 15…20 мин от начала управления.
Исходная модель управления была доработана и аналитически выражена в следующем виде:
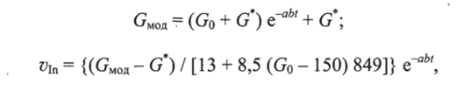
где GMOa, Go — модельная и начальная концентрация глюкозы в крови; G* - физиологическая норма; «i» — скорость инфузии инсулина; а = (1 IT) In [(Go + G*)/0,0776G']; b — коэффициент запаздывания действия инсулина, b = (1/1,5) arctg (/ 2/2250); t — время достижении нормогликемии.
На рис. 15.3, а приведен гликемический профиль, рассчитанный по модели Каримова. Начальное значение концентрации глюкозы в крови равно 300 мг%, установленная физиологическая норма — ПО ± 10 мг%, время достижения нормогликемии — 3 ч. Из рис. 15.3, а ясно, что в течение первых 15…20 мин заметного снижения гликемии нет. Концентрация достигает нормы G* в заданное время 3 ч и уже не выходит за пределы нормы, отмеченные штриховыми линиями.
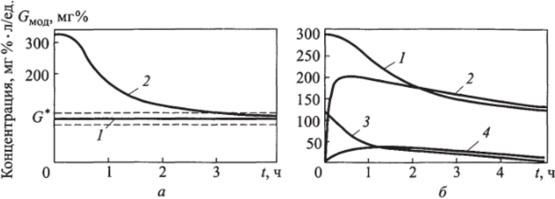
Рис. 15.3. Гликемические профили:
а — по модели Каримова (/ - норма; 2 — рассчитанный); б — по модели Болье (/ - глюкозы в крови; 2 — внесосудистой глюкозы; 3 — инсулина в крови; 4 — внесосудистого инсулина) Зависимость скорости инфузии инсулина от времени практически повторяет форму гликемического профиля, а при достижении нормогликемии инфузия продолжается с фоновой скоростью (2 ед./ч).
Программно-алгоритмическое обеспечение АРГ разработано с использованием средств модульного программирования и перемещаемости.
Возможности описанного АРГ могут быть расширены путем включения таких дополнительных функций лечебно-диагностического характера, как проведение глюкозотолерантного теста, стыковка с глюкозным сенсором и др. Сопряжение АРГ с графическим дисплеем позволяет улучшить наглядность процесса управления и восприятия информации. Предусмотрена возможность замены имеющейся математической модели на другие, при этом сервисные возможности АРГ сохраняются.
Модель Болье. Для описания динамики гликемии может быть использована нелинейная математическая модель В. Болье (рис. 15.3, б). В этой модели предполагается, что все процессы протекают в двух компартментах — сосудистом и внесосудистом.
В качестве выходных переменных в нелинейной модели приняты гликемия у и внесосудистая концентрация глюкозы у2, концентрация инсулина в крови (инсулинемия) у3 и внесосудистая инсулинемия у4. К входным переменным относят скорость vn инфузии экзогенного инсулина и скорость vrx поступления экзогенной глюкозы в кровь.
Скорость Уку{ (Ук — объем крови) изменения концентрации глюкозы зависит от скорости (уг-удРп (Р™ — транскапиллярная проницаемость глюкозы) поступления глюкозы из ВСЖ, скорости f4(yi) выделения глюкозы почками и скорости fs (y, у3) накопления глюкозы в печени.
Скорость Утлу2 (Уг" — внесосудистый глюкозный объем) изменения глюкозы в ВСЖ определяется скоростью (yt — уг)р!Л поступления глюкозы из крови и скоростью /б(у2, у а) утилизации глюкозы тканями.
Скорость Уку3 изменения инсулина в крови зависит от скорости инфузии экзогенного инсулина Win, скорости (у4 -уз)рь (pin — транскапиллярная проницаемость инсулина) поступления инсулина из ВСЖ, скорости yi (yi) секреции инсулина бета-клетками и скорости/2(уз) инактивации инсулина в крови.
Скорость У,"у4 (У]п — внесосудистый инсулиновый объем) изменения инсулина в ВСЖ определяется скоростью (у3 — у4)рп поступления инсулина из крови и скорости f2(y4) инактивации инсулина в ВСЖ.
В соответствии с этим изменение рассматриваемого состояния гликемии с течением времени описывается математической моделью в виде системы дифференциальных уравнений:
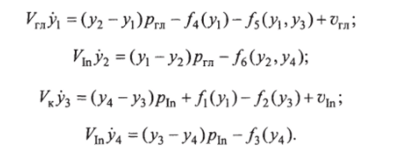
Для физиологических параметров этой системы приняты следующие значения: Ук=5 л; ^ =9 л; УГЛ=П л; ргл = р[п =6,2 л/ч. Единицы концентрации глюкозы у, у2 — г/л, концентрации инсулина у3, У4 — ед./л.
Для упрощения математических моделей процессов часто используется линеаризация. При этом реальный процесс у (-), со ().
делят на два: заданный у'(), о>*() и в отклонениях *(•), v (). Предполагается, что суммарный процесс у'(•) + *(•), w*() + v () достаточно точно аппроксимирует реальный.
Для описания процесса в отклонениях применяют линейные дифференциальные уравнения первого порядка, получаемые в результате линеаризации исходных нелинейных уравнений.
Если в качестве заданного процесса принять физиологические значения у! (•), у2 (•), Я (•), у4 (*)" то нелинейные функции f (i = 1,6) аппроксимируются следующим образом:

где функция /4 не аппроксимируется, так как это вступает в противоречие с аппроксимацией функции^.
Для описания динамики гликемии в отклонениях строят линейную модель в виде системы дифференциальных уравнений первого порядка:

где к = 7 ед./ч на г/л; к2 = 4 ед./ч на ед./л; к2 = 7,2 ед./ч на ед./л; к5х} = 12 г/л на ед./л; к5х[ = 44 г/л на г/л; к6хх = 92 г/л на ед./л; &6;t2 =.
= 14 г/л на г/л.
Упрощенная модель Болье. В упрощенной нелинейной математической модели динамики гликемии Болье рассматриваются только функции печени, бета-клеток поджелудочной железы и периферических тканей, взаимодействующих в одном компартменте.
В этой модели выходными переменными являются гликемия У (г/л) и инсулинемия у2 (ед./л), а входными — скорости цгл, vb инфузии глюкозы и инсулина соответственно. Объем V компартмента для пациента массой 70 кг принят равным 17,5 л.
После аппроксимации нелинейных функций f и/2 выражениями.

получают упрощенную линейную модель Болье в виде системы дифференциальных уравнений первого порядка с кинетическими константами ш, (коэффициентами чувствительности):

Упрощенная модель Болье описывается дифференциальными уравнениями.
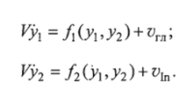
Здесь g = vT«IV h =oto /F; начальные условия Xi (/Ha4) = xi»a4,.
*2(/нач) 0.
Основное достоинство такой модели заключается в ее простоте. Область применимости модели ограничена диапазоном значений гликемии 30… 150 мг/дл и интервалом времени, не превышающим 5 ч.
Параметры модели, умноженные на объем компартмента, имеют следующий смысл. Чувствительность скорости метаболизма глюкозы к действию инсулина определяется величиной m2V, а к гликемии — величиной тV. Чувствительность скорости изменения инсулина к концентрации инсулина зависит от величины т2У, а к гликемии — от величины m4F. При патологии углеводного обмена коэффициент /и4 равен нулю, а коэффициент т близок к нулю.
Для констант приняты следующие значения: т = 2,92 г/(ч*л); т2 = 4,34 г/(чед.); т = 0,78 ч" 1; т4 = 0,208 ед./(чт).
Модель, А н том о нова. Научной школой профессора Ю. Б. Антомонова из Института кибернетики АН УССР в г. Киеве разработана математическая модель для описания процесса изменения гликемии в отклонениях.
В этой модели скорость изменения гликемии в воротной вене характеризуется скоростью vTn всасывания глюкозы в кишечнике и скоростью аХ.
Математическая модель изменения гликемии в воротной вене имеет вид.
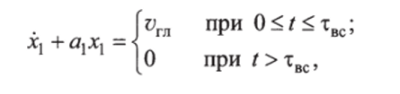
где а — коэффициент чувствительности; твс — время всасывания.
Скорость х2 изменения гликемии в печеночной вене определяется скоростями а4 х2, аз Х, зависящими от составляющих гликемии х9 х2; скоростью а2(уу), зависящей от гликемии у-у*; скоростями &1/Энд, b4i3K3 утилизации глюкозы вследствие действия эндогенного и экзогенного инсулина соответственно и скоростью cg роста гликемии под воздействием адреналина.
Для описания процесса получают дифференциальное уравнение.

где а2, аз, а4, Ь, Ь4, с — коэффициенты чувствительности Скорость изменения гликемии в тканях определяется скоростями а% Хз, а2(у — Аг3), зависящими от составляющих гликемии Хз, у — хз и от скоростей 6з/энд, b$i3ю утилизации. Процесс описан дифференциальным уравнением.
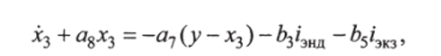
где а7, as, Ьз, bs — коэффициенты чувствительности.
С учетом изложенного текущую гликемию находят из выражения.

Скорость секреции инсулина бета-клетками характеризуется скоростью bzhнд, зависящей от инсулинемии, и скоростью, определяемой гликемией. Дифференциальное уравнение, описывающее процесс, имеет вид.
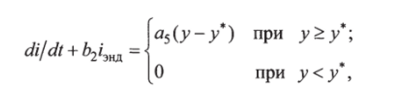
где а$, Ь2 — коэффициенты чувствительности.
Скорость инактивации экзогенного инсулина определяется скоростью уэкз переноса экзогенного инсулина кровотоком и скоростью bthm, зависящей от инсулинемии. Для описания процесса получим следующее дифференциальное уравнение: 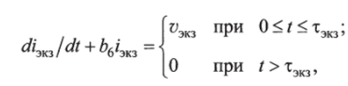
где тзкз — время утилизации экзогенного инсулина; Ь2 — коэффициент чувствительности.
Скорость секреции адреналина корой надпочечников обусловлена скоростью с2а, зависящей от концентрации адреналина, и скоростью, определяемой гликемией. Дифференциальное уравнение для описания процесса имеет вид.

где с2, а6 — коэффициенты чувствительности.
Для параметров процесса приводятся следующие значения: а = = а2 — а2 = 0,0333 мин-1; Ь = 0,0692 мг%/ (ед.-мин); Ь2 = 0,0086 мин" '; Ь2 = 0,1690 мг%/ (ед. • мин); а4 = 0,0025 мин-1; Ь4 = 0,2020 мг%/ (ед. • мин); а$ = 0,0056 ед./(мг% мин); Ьь = 0,0790 мг%/ (ед.-мин); а<, — - 0,0037−10_3 мин" 1; Ь6 = 0,0333 мин'1; а2 = 0,0099 мин" 1; С = = 0,3140−103 мин" 1.
При определенных допущениях можно использовать упрощенную математическую модель процесса изменения гликемии в виде системы линейных дифференциальных уравнений:
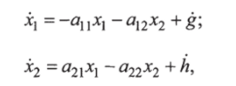
где дг), *2 — гликемия и инсулинемия в отклонениях; g — скорость введения глюкозы; h — скорость введения инсулина; <�зц, al2, а2, а22 — коэффициенты чувствительности.
Значения параметров процесса следующие: Пц = 0,2 833 мин4; «12 = 0,0333 мг%-мл-мин/мкед.; а21 = 0,3 833 мин-1; а22 = = 0,333 мкед.%мин.
Специально для прогноза может быть применена упрощенная математическая модель динамики гликемии в виде системы линейных дифференциальных уравнений: 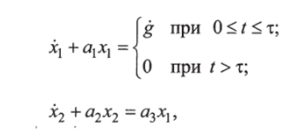
где jci — гликемия в отклонениях в воротной вене; х2 — гликемия в кровеносном русле; аи а2, а2 — коэффициенты чувствительности. Для переменной х2 получено аналитическое решение:

Модель Дэвиса. Математическая модель, предложенная М. Дж. Дэвисом, описывает динамику гликемии в отклонениях. Модель представляет собой выражение для скорости гликемии.

и выражение для скорости введения инсулина.
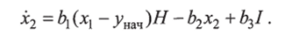
Особенность модели — предположение, что понижение гликемии происходит тем быстрее, чем выше гликемия х и инсулин Х2. Математически это записано нелинейной зависимостью в виде произведения хх2. Параметр а, характеризует чувствительность скорости гликемии к гликемии и инсулину, а оз — чувствительность гликемии к глюкозе в пище.
Выделение глюкозы печенью при гипогликемии отражается слагаемым, в котором параметр а2 характеризует чувствительность скорости гликемии к падению гликемии ниже нормы. Функция Н представляет собой ступенчатую зависимость:
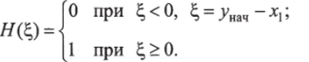
Предполагается, что введение глюкозы в организм с пищей производится мгновенно в момент г"ач в количестве Gm4 и далее расходуется экспоненциально:
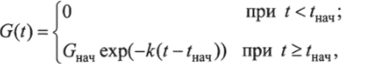
где к — параметр, характеризующий конкретную пищу.
Секреция инсулина бета-клетками отражается слагаемым, в котором параметр Ь характеризует чувствительность скорости изменения концентрации инсулина к гипергликемии. Функция Я выражается ступенчатой зависимостью:
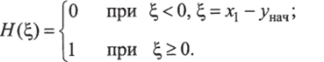
Инактивация инсулина отражается слагаемым, в котором параметр bi обусловлен чувствительностью градиента инсулина к инсулину. Половина свободного инсулина инактивируется 10…25 мин. При Ьг = 2 период полураспада равен 20 мин.
Введение
инсулина отражается слагаемым, в котором параметр bi характеризует чувствительность скорости изменения концентрации инсулина к инсулину, поступающему из депо, образованного экзогенно вводимой инъекцией I. Предполагается, что депо образуется с помощью подкожной инъекции мгновенно в момент t/, а поступление инсулина из него в кровь описывается кусочнолинейной функцией времени:

где /тах — максимальная концентрация инсулина в момент /тах; te — момент исчезновения инсулина.
В норме параметры имеют значения а = 0,05; «2 = 1,0; аз = = 4,0; Ь — 0,5; Ьг = 2,0.
Стандартное время приемов пищи и количество единиц: 8 чзавтрак, 50 ед.; 13 чобед, 100 ед.; 20 ч — ужин, 100 ед.
При диабете значения параметров а, и Ь уменьшаются, поэтому наступает аномальная гипергликемия, для устранения которой вводится инсулин. Параметр Ьз принимается равным единице. Для математического эксперимента а = 0,03, Ь{ =0,01. Начальные условия для дифференциальных уравнений:

На основе модели Антоманова была построена еще одна модель с допущением, что внешний источник инсулина отсутствует и фазовые переменные ограниченны: 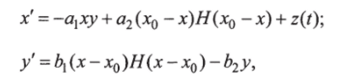
где ху у — концентрации глюкозы и инсулина в крови, (х, у) е гг = {(х, у), 0 < л: < jcmax, 0max}; ах, а2 и й" Ь2 (0, а2> О, Ь{ >0, Ьг > 0) — параметры, определяющие чувствительность х' к присутствию инсулина и к низкой концентрации глюкозы, а также чувствительности у к высоким концентрациям глюкозы и инсулина; H (s) = 1(0) — функция Хэвисайда, если 5 > 0(s < 0); z (/) — характеристика внешнего источника глюкозы (управление), принимающая значения в интервале [0; и] (п — параметр УДС).
Точка от(х0, 0) (состояние равновесия системы (15.4) при z (t) = 0) соответствует концентрации глюкозы в крови натощак при нулевом уровне инсулина.
Замыкание максимальной из безопасных зон области управляемости в точку от называют зоной иммунитета состояния от. Для рассматриваемой модели исследована зависимость зоны иммунитета состояния от от ограничений на характеристику z (t) и параметра bt. Показано, что сжатие области иммунитета при увеличении параметра п или уменьшении значения 6, вызвано изменением положения особых траекторий сшитых систем. Разделение особых траекторий у««{от) и у~(ДГ) (К — точка касания и-й траектории системы с 3Q) приводит к скачкообразному исчезновению зоны иммунитета. На плоскости параметров Ь{-п для а = 0,01, Ьг = 2, а2 = 1, Хо = 100, хтах= 600, Ушах = 400 построена бифуркационная кривая, соответствующая исчезновению этой зоны. Исследована зависимость множества управляемости U (om) от параметра 6, при фиксированном значении и.
у
Показано, что для 0 < 6, <-—— множество управляемости.
*шах -*0.
U (om) совпадает с множеством Q. При Ь{ =0 происходит скачкообразное уменьшение этого множества. Следовательно, при 6, = 0 в множестве Q появляется множество состояний (множество неуправляемости), переход из которых в множество П невозможен без введения внешнего источника инсулина.
Модель Бергмана. Робертом Бергманом была предложена математическая модель динамики гликемии, учитывающая торможение инсулином образования глюкозы. В качестве выходных переменных в этой модели приняты гликемия у, и величина у2 = kl, пропорциональная инсулинемии. Входной переменной служит скорость инфузии глюкозы на единицу объема компартмента.
В модели Бергмана скорости изменения переменных определяются уравнениями.

где р0 — ръ — коэффициенты скорости.
Комплексные модели. Помимо описанных моделей, были предприняты попытки создания комплексных моделей.
Западногерманскими исследователями на базе известных частных моделей углеводного обмена разработана модель, сводящая все важные органы в единую систему. С позиции математики эта модель представляет собой систему нелинейных дифференциальных уравнений с 29 компонентами. Модель расширяет результаты, полученные кратковременным прогнозированием, на суточный интервал.
Исследователи из Италии сформировали комплексную математическую модель, позволяющую дать описание краткосрочных процессов в системе метаболизма глюкозы. Модель состоит из трех подсистем, соответствующих глюкозе, инсулину и глюкагону. Подсистемы глюкозы и глюкагона включают в себя одну компоненту, подсистемы инсулина — пять компонент.
Учтена нелинейность ряда параметров. Для описания элементарных метаболических процессов применен агрегатный подход, в рамках которого зависимость между выходом и входом отображается с помощью функции гиперболического тангенса. Это позволяет учесть влияние управляющих переменных, меняя уровень насыщения и наклон характеристики. Математическая модель реализована на ЭВМ и испытана в различных условиях.
Аналоговая модель в виде эквивалентной электрической цепи для кинетики глюкозы предложена исследователями из Кореи.
Анализ математических моделей динамики гликемии показывает, что широкое распространение получили линейные модели в виде систем дифференциальных уравнений второго порядка относительно глюкозы и инсулина, играющих доминирующую роль в метаболизме углеводов. Для этих моделей разработаны методы идентификации параметров по данным глюкозотолерантного теста. Делаются попытки создания математических моделей относительно многих показателей метаболизма в различных органах и с учетом различных гормональных факторов.
Тенденции в области разработки математических моделей гликемии заключаются в том, что эти модели развиваются в направлении отображения процессов всех важнейших показателей метаболизма и основных гормонов и нелинейных эффектов их взаимодействия. Необходимо совершенствовать процедуры идентификации параметров математических моделей по минимальному числу клинических данных и разрабатывать математические индексы для количественной оценки тяжести патологических процессов метаболизма.
Параметрическая идентификация математических моделей динамики гликемии. Модель Болье считают классической среди моделей сахарного диабета, а описываемые с помощью нее процессы изменения как сосудистых, так и внесосудистых концентраций глюкозы и инсулина входят в вектор состояния.
Важнейшая проблема при разработке математических моделей динамики гликемии — их идентификация, т. е. численное определение параметров по экспериментальным данным. В качестве таких данных используют результаты измерения гликемии и инсулинемии в дискретные моменты времени после тестовой (задаваемой по определенному правилу) нагрузки глюкозой. Глюкоза может вводиться перорально или внутривенно, а измерения осуществляют натощак, через один и два часа после нагрузки и в случае необходимости еще чаще.
Для идентификации модели Болье, записанной для удобства в виде.
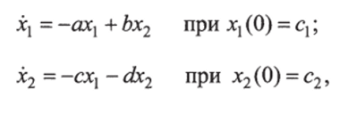
приводится алгоритм для обработки экспериментальных данных в виде значений инсулинемии Z|(/,) в моменты времени /, (/ = = 1, N) и в виде значений N2 гликемии г2(т,) в моменты време ни т, (/= 1,2, …, N2), t =Т| =0.
Задача состоит в таком подборе вектора параметров р = = [а, Ь, с, </]т, чтобы решения x (t, р), х2(/, р) системы дифференциальных уравнений как можно ближе, в смысле минимума функционала.
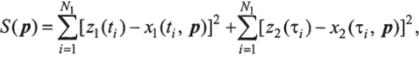
и с наименьшей погрешностью описывали экспериментальные точки.
Задача решается с помощью итерационного метода Ньютона — Гаусса.
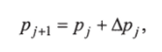
где j — шаг итерации; Др, — величина, вычисляемая по вектору отклонений.
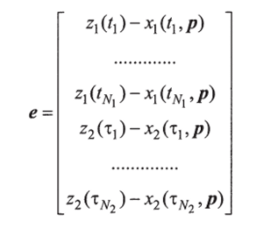
следующим образом: Ар, = (ХГХ) 1Хте.
Матрица чувствительности X состоит из производных х1а = дхх /да,
х2а=дх2/да, xib=dxjdb, х2Ь=дх2/дЬ, xu=dxjdc, х2с=дх2/дс, xd =dxJdd, x2d =dx2/dd, которые берутся прир = р2.
Матрица X имеет следующий вид:
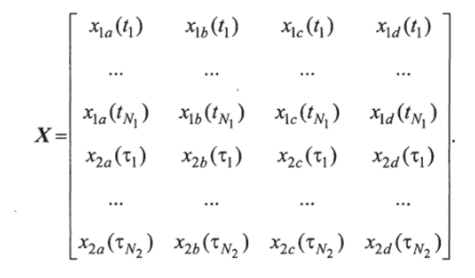
Для кратных корней элементы матрицы X определяют по выражениям.
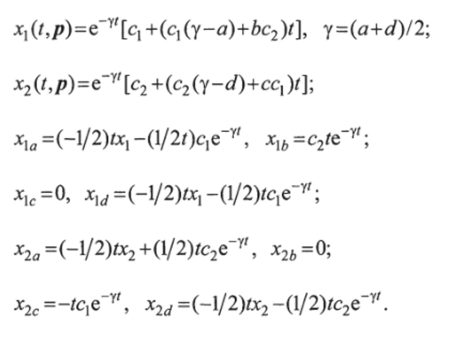
Компоненты вектора находят из решения системы линейных уравнений A&Pj = by где А =ХТХ; Ъ = Хте.
Алгоритм идентификации включает в себя последовательность следующих шагов, повторяемых в цикле. Первый шаг — задание начального приближения р0 и расчет элементов матрицы А и вектора Ь. Второй шаг — решение системы линейных уравнений, вычисление Apj и, следовательно, р. Цикл повторяется до тех пор, пока не достигается заданная точность или не исчерпывается заданное число итераций.

Ответственный шаг алгоритма — выбор начального приближения ро. Достаточно правильную начальную оценку параметров можно выполнить на основе анализа экспериментальных данных, грубо оценив скорость изменения гликемии и инсулинемии.
Начальная оценка параметров проводилась следующим образом. Известно, что период полураспада инсулина равен примерно 10 мин. Отсюда для параметра а имеем а = 0,1 мин" 1. Приняв, что увеличение гликемии на 100 мг (100 мл) повышает инсулинемию в течение 10 мин на 200 мкед./мл, для величины b получим.

Параметр d соответствует скорости утилизации глюкозы без действия инсулина. Известно, что значение d обычно мало: d = = 0,001 мин'1. Анализируя экспериментальные данные, так же как и для параметра b, найдем начальную оценку для параметра с:
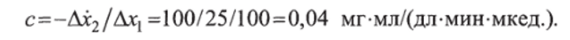
Математические модели динамики гликемии можно использовать при количественной диагностике патологии углеводного обмена. Основанием для этого служит тот факт, что нормальный процесс изменения гликемии соответствует вполне определенным значениям параметров модели. Патологический процесс изменения гликемии имеет место при значениях параметров, существенно отличающихся от нормальных. Различие в значениях параметров, соответствующих норме и патологии, может служить количественной мерой в оценке нарушений углеводного обмена.
Существенно, что эта мера не зависит от значения гликемии натощак, также используемой для количественной диагностики. Дополняя друг друга, оба типа показателей позволяют увеличить достоверность диагноза.
Актуальная задача количественной диагностики — сведение числа информативных параметров модели к минимуму. В качестве методики решения этой задачи можно выбрать переход к преобразованным параметрам. Так, для линейной модели Болье имеет место переход к дифференциальному уравнению второго порядка.

где, а показатель затухания, <�х=(12)(тх +т2); сйд — квадрат собственной частоты, (Од =т{тг +т2т4; т1 -т4 — параметры модели.
Также применяют следующие параметры: Т=2п/щ — период колебаний; со2 =0Ода2 — квадрат круговой частоты.
В случае перорального глюкозотолерантного теста скорость внутрикишечной абсорбции глюкозы быстро выходит на плато и остается постоянной до тех пор, пока большая часть глюкозы не поглотится в кишечнике. В связи с этим предполагают, что.
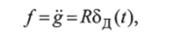
где R — константа; 8Д (/) — функция Дирака.
Динамика гликемии описывается выражением или выражением.

при кратных корнях характеристического уравнения.
Площадь, ограниченную кривыми x (t), хнач = const, / = 0, определяют по формуле.
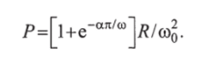
Время наступления максимума гликемии находится как, а сам максимум.
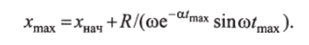
При аппроксимации имеем.
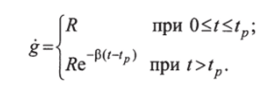
Динамика гликемии описывается выражением.

Установлено, что в норме время / = 4 ч, а при патологии оно превышает это значение. Следовательно, параметр t и производная от него величина соо содержат существенную диагностическую информацию. Наиболее информативен показатель р.
Для модели Бергмана по данным о параметрах определяют индекс S, мин~' (мкед./мл), чувствительности к инсулину, характеризующий удельную утилизацию глюкозы под действием инсулина:

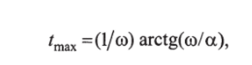
где индекс ss обозначает установившееся состояние. Величину Е находят по выражению.
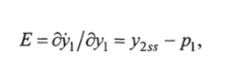
гДе Уг$$=-Рг1 Pi1 ss-
Следовательно, Еа = —рг / p2Iss — Р и окончательно имеют S = -p/p2.
Для внутривенной инъекции глюкозы 330 мг/кг 5= 5,1.
С учетом введения индекса 5 дифференциальные уравнения математической модели Бергмана принимают вид.
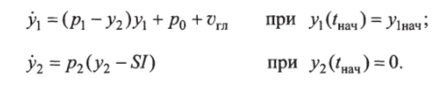
Определение зависимости доза воздействия — эффект. Важнейшая проблема в задаче управления патологическим процессом — выработка общих рекомендаций по составу и характеру данных, подлежащих преобразованию в операторе управления.
Часть данных, относящихся к цели процесса и производящих функции (кроме неопределенных факторов), обычно известна до начала процесса для всего промежутка времени /.
Другая часть данных, представляющая собой информацию о текущих состояниях процесса, непредсказуема заранее вследствие условий неопределенности. Поэтому каждое текущее состояние необходимо считать варьируемым.
С точки зрения достижения цели процесса, различные моменты текущего времени становятся неравнозначными в результате непрерывного убывания по ходу процесса интервала времени tk… t, располагаемого на достижение цели. Следовательно, произвольной становится всякая совокупность {t, y} текущего состояния и времени, которому это состояние соответствует. Указанная совокупность — это позиция, полная и достоверная информация о которой должна своевременно доставляться с помощью процедуры наблюдения.
Таким образом, при управлении в условиях неопределенности преобразование данных в сигнал управления характеризуется тем, что данные о текущей позиции являются варьируемыми. Управление, формируемое с использованием данных о фактически реализующихся текущих позициях, представляет собой регулирование по принципу обратной связи и носит название позиционного управления. Принцип обратной связи воплощает идею формирования управления в зависимости от соответствия текущей фактической позиции процесса и намеченной цели.
Варьируемость данных о каждой текущей позиции, из которой необходимо обеспечивать достижение заданной цели, приводит к выводу, что оператор управления должен быть представлен в виде алгоритма. Этот вывод обосновывается тем, что в общем случае алгоритм интуитивно определяется как точное предписание о порядке выполнения некоторого набора логико-математических действий над варьируемыми исходными данными для достижения искомого результата.
Возможны два подхода к синтезу алгоритмов управления патологическими процессами. Первый подход характеризуется эвристическим синтезом, основанным на опыте исследователя и глубоком анализе механизмов саморегуляции организма. Второй подход — регулярным синтезом и базируется на регулярной методике, включающей в себя ряд содержательных приемов, постановку и решение строгих математических задач.
Исходный этап регулярного синтеза алгоритмов управления патологическими процессами — формализация задачи, вызванная, главным образом, наличием условий неопределенности. Эти условия придают задаче управления своеобразную расплывчатость и не позволяют использовать аппарат дифференциальных уравнений для строгого выполнения терминальных условий. Поэтому в первую очередь формализация предназначена для преодоления неопределенности путем выдвижения вместо неопределенных факторов гипотез информированности исследователя. При формализации могут вводиться упрощающие допущения и выдвигаться эвристические идеи. Математическая модель, полученная из математического имитатора, в котором тем или иным образом преодолена неопределенность, представляет собой уравнения состояния патологического процесса.
Широко распространенный способ преодоления неопределенности — введение гипотезы о наименее благоприятном (с точки зрения обеспечения экстремума специального функционала) характере неопределенных факторов. Однако эта гипотеза позволяет определить лишь границы поведения системы и, кроме того, требует обоснованного использования специального критерия для оценки противоположных интересов исследователя и «природы», порождающей неопределенные факторы. Результаты применения рассматриваемой гипотезы известны под названием принципа наилучшего гарантированного результата.
Следует отметить, что гипотеза информированности при решении задач управления должна заменять в математическом имитаторе процесса не только текущие значения неопределенных факторов, но и будущие, ожидаемые в перспективе до конца процесса. Другими словами, гипотеза информированности должна выполнять функцию прогноза.
Этот прогноз д (-), <�"(•), имеющий содержательный характер, позволяет путем решения дифференциального уравнения вида.
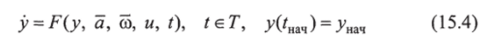
при некоторой известной функции «(•) получить уже чисто формальный прогноз исследуемого процесса для промежутка будущего времени I. Двухступенчатость прогноза — специфическая черта исследования патологических процессов в условиях неопределенности.
Цель — достичь определенной концентрации глюкозы в крови через заданный промежуток времени. Физиологическая норма гликемии известна, время достижения нормогликемии задано. Следует определить, какова при этом будет концентрация инсулина и глюкозы:
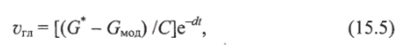
где С = 1,2686 + 0,253 0; d = (In G* - In G0) /Т, а = (11Т) ln[(G0 + + G*)/0,0776 G*].
Аналитическое выражение для расчета модельной концентрации глюкозы крови в случае гипогликемии следующее:

тогда для скорости введения глюкозы в формуле (15.5). Как было установлено ранее, скорость инфузии инсулина (г/ч).
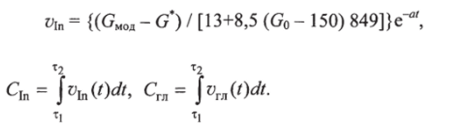
Таким образом, задавая параметры, получают концентрации и скорости введения веществ.
Верификация моделей. Как показывает клинический опыт, в ряде случаев контролировать заболевания можно как путем определения онцентрации глюкозы в моче, так и в крови. При этом используют различные схемы нахождения: в моче, собранной за сутки или в определенные периоды суток.
Повышенная концентрация глюкозы в моче, собранной за сутки, указывает на высокий уровень ее в крови и свидетельствует о декомпенсации заболевания, хотя и не позволяет определить, в какое конкретно время суток возникает гипергликемия.
Определение глюкозурии в отдельные периоды суток дает возможность более точно установить, в какое время отмечается наибольшая нестабильность показателей гликемии, что позволяет провести соответствующую коррекцию глюкозоснижающей терапии. Иногда, при установлении концентрации глюкозы в моче, полученной через 10… 15 мин после опорожнения мочевого пузыря, можно с заданной долей вероятности оценить выраженность гипергликемии в данный момент.
При гипергликемии, когда введенная в систему концентрация глюкозы выше модельной, инсулин поступает с большей скоростью, и наоборот. Соответственно удлиняется или укорачивается время достижения нормогликемии. Дальнейшее поддержание нормогликемии обеспечивается режимом фоновой инфузии инсулина. В случае повторного повышения концентрация глюкозы в крови вновь включается режим оперативной инфузии инсулина. Если имеет место перерегулировка и концентрация глюкозы падает ниже допустимой нормы, то осуществляется переход к режиму инфузии глюкозы.
Описание структуры и проектирование БТС. Разработан ряд технических средств, реализующий различные алгоритмы управления процессами изменения гликемии. На рис 15.4 приведена блок-схема управления гликемией, предложенная Н. С. Каримовым.

Рис 15.4. Блок-схема управления гликемией:
СУИ — схема управления инфузией В начале работы на экран алфавитно-цифрового дисплея (АЦД) выводится таблица начального состояния системы с нулевыми установками. Оператору необходимо набрать на клавиатуре значение исходной концентрации глюкозы в крови (мг%), измеренного с помощью глюкозного анализатора.
По введенному начальному значению гликемии микропроцессорная система автоматически рассчитывает параметры математической модели: начальную скорость введения инсулина, физиологическую норму гликемии, время достижения нормогликемии, коэффициенты.
Далее вычисляется модельная концентрация глюкозы в крови (в начальный момент GMoa = Go) и скорость инфузии инсулина (ед./ч), которая затем преобразуется в частоту и выводится на инфузор инсулина или глюкозы. Работа инфузоров происходит с заданной частотой, независимо от микропроцессора по схеме управления инфузорами (СУИ). Смена скоростей инфузии препаратов производится микропроцессором путем подачи необходимых сигналов на СУИ. Инфузоры непосредственно связаны с биообъектом.
Согласно принятому алгоритму функционирования, БТС обеспечивает ежеминутный расчет скоростей инфузии препаратов и отображение на экране дисплея значений модельной концентрации, текущего времени, скоростей инфузии и количество инфузированных препаратов.
Система также обеспечивает диалоговый режим работы с пользователем, максимальную простоту эксплуатации, выдачу информации в наглядном для врача виде, защиту от некорректных ситуаций. При каждом вводе реальной концентрации, отличающейся от модельной, текущее состояние системы запоминается в специально зарезервированном участке памяти. В последующем эти состояния по команде пользователя могут быть. выведены на дисплей и печатающее устройство. Предусмотрено прогнозирование состояния системы на будущее, а также просмотр прошедших событий для любого значения концентрации в любой момент времени. При этом обеспечивается сохранность текущего реального состояния системы.
Данные о параметрах моделей, приведенные в табл. 15.2, являются результатом применения алгоритмов управления гликемией на основе соответствующих математических моделей, а также выявления их чувствительности к разнообразным вариациям.
Таблица 15.2. Данные о параметрах моделей динамики гликемии.
Параметр | Значение. | Пояснение. |
Модель Каримова | ||
Go, мг%. | Начальное значение концентрации. | |
G мг%. | 110 ± 10. | Физиологическая норма. |
L ч. | Время достижения нормогликемии. | |
Модель НГУ | ||
а, | 0,01. | Параметры, определяющие чув; |
а2 | 1,0. | ствительности к присутствию. |
Ь | 0,1. | инсулина и низкой концентрации. |
ь2 | 2,0. | глюкозы. |
*0. | ||
?*тах. | ||
Утп_. | ||
Параметр | Значение. | Пояснение. |
Модель Болье | ||
Объем крови: | ||
К, л | общий. | |
^ГЛ" Л. | внесосудистый глюкозный. | |
Кщ, Л. | внесосудистый инсулиновый Транскапиллярная проницаемость: | |
Ргл, л/ч. | 6,2. | глюкозы. |
Pin, Л/Ч. | 6,2. | инсулина. |
Упрощенная модель Болье | ||
Ль ед./ч на г/л. | ||
Л2> ед. /ч на ед. /л. | ||
?3, ед. /ч на ед. /л. | 7,2. | |
Л&ь г/л на г/л. | Экспериментальные параметры. | |
?5*3, г/л на ед. /л. | ||
Лбх2, г/ч на г/л. | ||
А4, г/ч на ед. /л. | ||
Упрощенная модель Болье (ограниченная). | ||
Параметр чувствительности глюкозы: | ||
/я, ч" 1 | 2,92. | к гликемии. |
т2, г-ед./ч. | 4,34. | к инсулину. |
w3, ч" 1 | 0,78. | Параметр чувствительности инсулина: |
к инсулину. | ||
/я4, ед. (г/ч). | 0,208. | к глюкозе. |
Модель Антомонова и ее упрощенный аналог | ||
аи а2, аг, Ь6, мин" 1 | 0,0333. | |
а4, мин"1 | 0,0025. | |
а5, ед./(мг% мин). | 0,0056. | |
ав, у%/(мг% мин). | 0,0037. | |
a-j, мин-1 | 0,0099. | |
а^, мин-1 | 0,0250. | |
Ь, мг%/(ед. мин). | 0,0692. | Коэффициенты чувствительности. |
Ь2, мин" 1 | 0,0086. | |
Ьз, мг%/- (ед.мин). | 0,1690. | |
Ь4, мг%/- (ед. мин). | 0,2020. | |
bs, мг%/- (ед. мин). | 0,0790. | |
Си мг%/ (у%-мин). | 0,3140. | |
с2, мин" 1 | 0,0333. | |
Параметр | Значение. | Пояснение. |
Оц, мин" 1 | 0,2 833. | |
а[2, мг%/мкед./мл мин. | 0,0333. | |
а21, мкед./мл/мл% мин. | 0,833. | |
022, мин" 1 | 0,3 833. | |
Модель Дэвиса | ||
Параметр чувствительности: | ||
а | 0,05. | глюкозы к гликемии. |
1,0. | глюкозы к давлению. | |
Оз. | 4,0. | глюкозы к глюкозе пищи. |
ь, | 0,5. | концентрации инсулина к. |
гликемии. | ||
±_. | 2,0. | градиента инсулина к инсулину. |