Лабораторная работа № 10. Изолирование и культивирование апикальных меристем картофеля

Проростки (2 см) отделить от клубней и поместить в чашки Петри со стерилизующими растворами: в диацид на 3—5 мин, в спирт на 1—2 мин. Проростки промыть 3 раза стерильной дистиллированной водой и перенести в стерильные чашки Петри. Тонкой препаровальной иглой у проростков удалить все листья, последовательно обнажая верхушечные и боковые меристемы с примордиями. Меристему с 1—2 примордиями отделить… Читать ещё >
Лабораторная работа № 10. Изолирование и культивирование апикальных меристем картофеля (реферат, курсовая, диплом, контрольная)
В культуре тканей можно размножать растения и получать оздоровленный (безвирусный) посадочный материал. Для оздоровления растений используют культуру апикальных меристем. Активно делящиеся клетки конуса нарастания, расположенного на верхушке побега, не содержат вирусов. Обычно на питательные среды высаживают небольшую часть меристемы до 0,5 мм. Чем меньше величина меристемы, тем больше вероятность получения безвирусных растений. Биотехнология позволяет получать безвирусный оздоровленный посадочный материал практически всех сельскохозяйственных культур.
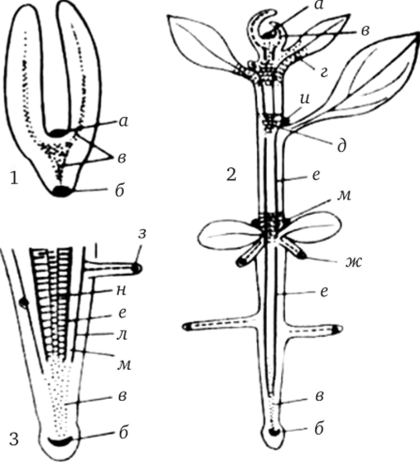
Меристематические ткани:
1 — в зародыше семени, 2 — в проростке растения, 3 — в кончике корня; а — верхушечная меристема побега, б — верхушечная меристема корня, в — прокамбий, г — интеркалярная меристема листа, д — интеркалярная меристема побега, е — камбий, ж — верхушечная меристема придаточного корня, з — верхушечная меристема бокового корня, и — верхушечная меристема пазушной почки, к — ксилема, л — перицикл, м — флоэма Наиболее полно разработана технология получения безвирусного картофеля. В культуре тканей используются апексы верхушечных и боковых почек. Клубни картофеля хранят при 4—6°С, затем проращивают при 20—22°С.
Цель работы: получить апикальные меристемы картофеля и пронаблюдать за развитием из них побега.
Оборудование и материалы: ламинар-бокс, бинокулярный микроскоп, флаконы со стерилизующими растворами (0,2% диацид или 70% спирт), чашки Петри, стерильная дистиллированная вода, стерильные инструменты: пинцеты, препаровальные иглы, скальпели, спиртовка, пробирки со средой.
Объект исследования: проростки картофеля.
Таблица 3
Модифицированная питательная среда Мурасиге — Скуга для культивирования апикальных меристем картофеля.
Компоненты питательной среды. | |
Маточный раствор макросолей. | 50 мл/л. |
Маточный раствор микросолей. | 1 мл/л. |
Fe-хеллат. | 5 мл/л. |
СаС12 | 50 мл/л. |
Тиамин-НС1. | 1 мг/л. |
Пиридоксин-НС1. | 1 мг/л. |
Витамин В12 | 0,015 мг/л. |
Никотиновая кислота. | 2 мг/л. |
Фолиевая кислота. | 0,5 мг/л. |
Мезоинозит. | 100 мг/л. |
Г идролизат казеина. | 1 г/л. |
Аденин. | 40 мг/л. |
Пантотенат Са. | 10 мг/л. |
Рибофлавин. | 0,5 мг/л. |
Биотин. | 1 мг/л. |
Активированный уголь. | 10 г/л. |
ГК. | 2 мг/л. |
Кинетин. | 0,5 мг/л. |
Сахароза. | 20 г/л. |
Глюкоза. | 20 г/л. |
Агар-агар | 7 г/л. |
pH 5,7—5,8. | |
Ход работы: поверхность ламинара, штативы, пробирки, микроскоп обработать ультрафиолетом и 96% спиртом. Руки протереть спиртом. Препаровальные иглы, пинцеты, скальпели поместить в 96% спирт и перед каждой манипуляцией обжигать на пламени спиртовки.
Проростки (2 см) отделить от клубней и поместить в чашки Петри со стерилизующими растворами: в диацид на 3—5 мин, в спирт на 1—2 мин. Проростки промыть 3 раза стерильной дистиллированной водой и перенести в стерильные чашки Петри. Тонкой препаровальной иглой у проростков удалить все листья, последовательно обнажая верхушечные и боковые меристемы с примордиями. Меристему с 1—2 примордиями отделить от проростков, при этом величина экспланта должна быть не более 100—250 мкм. Экспланты перенести в пробирку на поверхность питательной среды. Пробирки закрыть пробками, поместить в штатив и перенести в культуральную комнату. В культуральной комнате поддерживают температуру 25 °C, влажность воздуха 70%, освещенность 5 кЛк и фотопериод 16 ч.
В среднем от посадки меристемы на среду до формирования проростков с 5—6 листочками проходит 30—45 дней, в некоторых случаях от 2 до 8 месяцев. Среды по мере истощения обновляют, и проростки периодически пересаживают на новые среды в стерильных условиях.
Задание: через 2, 3, 4 недели проводят наблюдение за развитием из меристемы побега, результаты зарисовать и сделать выводы.