Нейромедиаторные нарушения и генетика ГРДВ

С начала 1990;х гг. идентифицировано несколько вариантов генетических дефектов, ассоциированных с ГРДВ. Нередко их называют «гены ГРДВ», но в этом выражении содержится неточность, поскольку каждый из них определяет только наследственную предрасположенность к гиперактивному расстройству. Малого числа генов ГРДВ недостаточно для того, чтобы вызвать значительные искажения в обмене дофамина или… Читать ещё >
Нейромедиаторные нарушения и генетика ГРДВ (реферат, курсовая, диплом, контрольная)
Нейромедиаторы — биологически активные вещества, выделяемые нервными окончаниями, которые обусловливают проведение нервных импульсов в синапсах. Медиаторы — это химические посредники нервного возбуждения. Сегодня известно более 50 различных нейромедиаторов. Наиболее важными медиаторами ЦНС являются дофамин, норадреналин (оба относятся к катехоламинам), серотонин, ацетилхолин и гамма-аминомасляная кислота. Дисфункции нейромедиаторных систем мозга могут быть обусловлены как ранним органическим повреждением ЦНС, так и генетическими механизмами. Согласно современным представлениям, важную роль в патогенезе ГРДВ играет дисфункция нейромедиаторных систем мозга, прежде всего дофаминергической и норадренергической. В пользу нарушений со стороны нейромедиаторных систем как первичного звена в развитии ГРДВ свидетельствует то, что основной механизм действия стимуляторов ЦНС (эффективных препаратов в терапии ГРДВ) заключается в активации высвобождения и торможения обратного захвата дофамина и норадреналина в пресинаптических нервных окончаниях, что увеличивает биологическую доступность нейромедиаторов на уровне синапсов.
Основные образования дофаминергической системы локализуются в среднем мозге. Они представлены черной субстанцией (ее проекции направляются к хвостатому ядру) и вентральной покрышкой, которая связана с лимбической системой — прилегающим ядром (nucleus accumbens), обонятельным бугорком и корой лобной доли. Структуры норадренергической системы локализуются в области моста (голубое пятно). Нейроны голубого пятна образуют диффузные проекции большой протяженности, достигая практически всех отделов коры больших полушарий, отдельные пути направляются к таламусу, гипоталамусу, мозжечку.
Как было показано в предыдущих главах, развитие ГРДВ связано с нарушениями функций лобно-стриарных структур головного мозга. Однако проводящие пути связывают подкорковые образования с корой лобной доли не напрямую, а через синапсы. Термин «синапс» в переводе с греческого языка означает «соединение». Передача импульса в нервной системе происходит в несколько этапов: 1) проведение по нервному волокну электрического импульса; 2) процесс химической передачи в синапсе с помощью химического передатчика — нейромедиатора — через пространство, разделяющее мембраны контактирующих клеток, которое называется синаптической щелью и является составной частью синапса; 3) проведение электрического импульса по следующему нервному волокну. С физиологической и биохимической точек зрения второй этап является наиболее сложным. Он представляет собой цепь процессов, суть которых сводится к преобразованию электрического сигнала в химический, а затем — химического в электрический. В химическом синапсе приходящие нервные импульсы вызывают освобождение из пресинаптических окончаний нейромедиаторов — вырабатываемых нервными клетками физиологически активных веществ, которые диффундируют через синаптическую щель и воздействуют на специфические белки-рецепторы постсинаптической мембраны, изменяя при этом электрическую активность воспринимающего нейрона. Нарушения процессов синаптической передачи влекут за собой разобщение, перерыв связей между лобными долями и подкорковыми образованиями; вследствие этого развиваются симптомы ГРДВ.
Роль дофамина и норадреналина в генезе ГРДВ представлена в модели, предложенной Плицка С. и соавт. (Pliszka S. et al., 1996) (рис. 6.5). Эти авторы рассматривают две системы внимания, по М. Познеру и соавт. (1990): заднемозговую систему внимания, которая отвечает за ориентировку на новые стимулы, и переднемозговую систему внимания, обеспечивающую управляющие функции. В заднемозговую ориентировочную систему входят верхняя теменная кора, верхнее двухолмие, подушка зрительного бугра (доминирующее значение при этом принадлежит правому полушарию); эта система получает плотную норадренергическую иннервацию от locus coeruleus (голубое пятно). Норадреналин подавляет спонтанные разряды нейронов, что увеличивает в клетках-мишенях соотношение сигнальных импульсов к помехам; тем самым заднемозговая система внимания подготавливается к работе с новыми стимулами. Вслед за этим происходит переключение механизмов внимания на переднемозговую управляющую систему, в которую входят префронтальная кора и передняя часть поясной извилины. Восприимчивость этих структур по отношению к поступающим сигналам модулируется за счет дофаминергической иннервации от вентрального ядра покрышки среднего мозга. Дофамин избирательно регулирует и ограничивает возбуждающую импульсацию к префронтальной коре и поясной извилине, обеспечивая снижение излишней нейрональной активности во время осуществления управляющих функций.
Согласно этой концепции (Pliszka S. et al., 1996), дефицит внимания у детей с ГРДВ обусловливается нарушениями связанной с норадренергической регуляцией работы заднемозговой системы внимания, тогда как расстройства дофаминергического контроля поступления импульсов к переднемозговой системе могут определять расстройства поведенческого торможения и управляющих функций, также характерные для ГРДВ.
Все химические процессы в клетках организма находятся под контролем генов. Процессы метаболизма дофамина и норадреналина на уровне синапсов не являются исключением. За каждый из этапов отвечает специальный ген, поэтому существует в буквальном смысле множество генов дофаминергической и норадренергической систем мозга, кодирующих определенные белковые структуры, участвующие в обмене нейромедиаторов. К настоящему времени при ГРДВ установлены нарушения структуры и функций нескольких генов, отвечающих за различные белки. Поскольку метаболизм нейромедиаторов может расстраиваться на разных этапах, рассмотрим последовательность этих процессов более подробно.
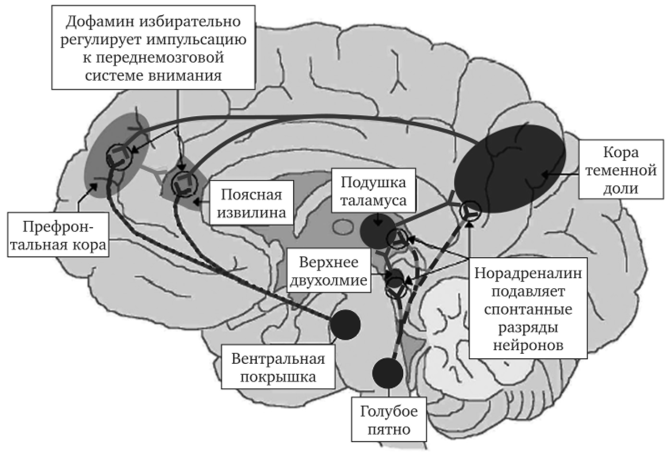
Рис. 6.5. Срединно-сагиттальное изображение мозга, иллюстрирующее многостадийную модель ГРДВ (по Plizska S. et al., 1996).
- • — переднемозговая система внимания;
- • — заднемозговая система внимания
Сначала нейромедиаторы должны быть выработаны нервными клетками из исходных веществ (синтез). Каждый нейрон обладает биохимическим «аппаратом», который необходим для синтеза специфических медиаторов, выделяющихся из окончаний его аксона. После выработки молекулы медиатора накапливаются и хранятся в окончании аксона в мелких везикулах, связанных с мембраной. В одном окончании могут быть тысячи синаптических пузырьков, каждый из которых содержит от 10 до 100 тыс. молекул медиатора. Приход нервного импульса в окончание аксона вызывает высвобождение множества молекул медиатора из окончания в синаптическую щель. Следующий этап — взаимодействие с рецептором. Вышедшие молекулы медиатора быстро проходят через наполненную жидкостью щель между окончанием аксона и мембраной воспринимающего нейрона. Здесь они взаимодействуют со специфическими рецепторами постсинаптической мембраны. Рецепторы представляют собой крупные белковые молекулы, погруженные в полужидкую матрицу клеточной мембраны. Выходящий на поверхность участок рецепторного блока и молекула медиатора имеют одинаковые очертания, они соответствуют друг другу как ключ и замок. Окончательное действие медиатора происходит при его взаимодействии с рецептором, которое меняет трехмерную форму рецепторного белка, инициируя тем самым определенную последовательность событий, приводящую к возбуждению или торможению нейрона. После того как молекула медиатора свяжется со своим рецептором, она должна подвергнуться расщеплению и инактивации во избежание слишком длительного ее действия и нарушения точного контроля передачи. Между тем количество нейромедиатора в синаптической щели определяется не только его высвобождением, но и повторным использованием после частичной реабсорбции (обратного захвата), которая осуществляется специальным белком-переносчиком. Процессы обратной связи, сигнализирующие нервным клеткам о том, достаточное количество медиатора содержится в синаптической щели или нет, регулируются с помощью ауторецепторов нервных окончаний. Лишние молекулы медиатора связываются с ауторецепторами, и пока часть ауторецепторов остается свободной, выделение медиатора в синаптическую щель продолжается.
С начала 1990;х гг. идентифицировано несколько вариантов генетических дефектов, ассоциированных с ГРДВ. Нередко их называют «гены ГРДВ», но в этом выражении содержится неточность, поскольку каждый из них определяет только наследственную предрасположенность к гиперактивному расстройству. Малого числа генов ГРДВ недостаточно для того, чтобы вызвать значительные искажения в обмене дофамина или норадреналина и тем самым привести к ГРДВ. Это связано с существованием большого количества компенсаторных механизмов в путях метаболизма нейромедиаторов в синапсах. Например, на снижение высвобождения дофамина из везикул отреагирует по механизму обратной связи ауторецептор, и уровень дофамина будет поддерживаться за счет увеличения его синтеза и уменьшения обратного захвата. Поэтому присутствие незначительного числа дефектных генов дофаминергической и норадренергической систем встречается у вполне обычных людей. Предполагается, что это может быть результатом ранних этапов эволюции человека, когда повышенная двигательная активность и импульсивность обеспечивали определенные преимущества. Возможно, что индивидуумы с данными чертами могли успешнее других охотиться и добывать пищу; кроме того, у них было больше сексуальных партнеров и дефектные гены нейромедиаторных систем от таких родителей чаще, чем обычно, передавались многочисленным потомкам.
Большинство современных исследователей считают ГРДВ полигенным расстройством, при котором одновременно существующие многочисленные нарушения процессов обмена дофамина и/или норадреналина обусловлены влияниями нескольких генов, перекрывающими защитное действие компенсаторных механизмов. Эффекты генов, вызывающих ГРДВ, являются аддитивными, взаимодополняющими. Таким образом, ГРДВ практически не рассматривается в настоящее время как расстройство с простым моногенным наследованием, определяемым единственным геном, а расценивается как полигенная патология со сложным и вариабельным наследованием, развитие которой детерминируется комбинацией из нескольких генов. В то же время ГРДВ представляет собой генетически гетерогенное состояние.
Несколько примеров генов, определяющих предрасположенность к ГРДВ, представлено в табл. 6.2. Все эти гены локализованы на различных хромосомах. Наиболее изученными среди них являются DRD4 — ген дофаминовых рецепторов четвертого типа и DAT1 — ген белка — переносчика дофамина. Индивидуумы с ГРДВ чаще, чем другие люди, являются носителями аномальных вариантов данных генов.
Таблица 6.2
Гены, которые могут определять наследственную предрасположенность к ГРДВ.
Генетически регулируемые системы и процессы. | Гены. |
Дофаминергическая система. | DRD4, DRD5, DAT1/SLC6A3, DBH, DDC. |
Норадренергическая система. | NET1/SLC6A2, ADRA2A, ADRA2C. |
Серотонинергическая система. | 5-HTT/SLC6A4, HTR1B, HTR2A, ТРН2. |
Нейрональная пластичность и нейромедиаторная передача. | SNAP25, CHRNA4, NMDA, BDNF, NGF, NTF3, NTF4/5, GDNF. |
Нейроонтогенез. | CDH13. |
Ген DRD4 контролирует образование одного из пяти известных типов дофаминовых рецепторов, т. е. кодирует белок, который распознает дофамин на поверхности воспринимающей нервной клетки (рецептор дофамина четвертого типа). Разные аллели этого гена различаются по длине, зависящей от числа повторов определенного отрезка ДНК из 48 пар нуклеотидов в одном из кодирующих участков гена (экзон 3). Этих повторов у человека может быть от двух до одиннадцати, причем в европейской популяции наиболее часто встречаются генотипы с четырьмя и семью, а в некоторых странах Азии — с четырьмя и двумя повторами. Вариант этого гена, ассоциированный с ГРДВ, имеет длину, превышающую нормальную — число повторов равно семи, тогда как в норме в генотипе человека чаще содержится от двух до четырех таких повторов. Оказалось, что носители разных аллелей DRD4 отличаются чувствительностью рецептора к дофамину — чем длиннее вставка, тем ниже чувствительность рецептора к дофамину. Вследствие этого при ГРДВ на рецепторном уровне снижается способность к связыванию дофамина и реагированию на него. Было установлено, что данный аллельный вариант гена DRD4 встречается с повышенной частотой не только у детей с ГРДВ, но и у лиц со свойством темперамента, называемым «поиском новизны». Испытуемые, обладающие длинными повторами нуклеотидных пар, имеют более высокие оценки по «поиску новизны», чем те, которые унаследовали от родителей короткие аллели. Это означает, что носители длинного гена в среднем любознательнее и экстравагантнее, импульсивнее и раздражительнее, более склонны нарушать правила, преграждающие им доступ к получению удовольствий (Алфимова М. В., Голимбет В. Е., 2003). Очевидно, ген DRD4 играет роль в формировании импульсивного поведения у детей с ГРДВ, но не нарушений внимания, что может объяснять склонность к рискованным формам поведения, которые характерны именно для импульсивных детей с ГРДВ.
Не исключено, что наряду с дофаминовыми рецепторами четвертого типа в генезе ГРДВ участвуют также другие типы рецепторов дофамина. Поэтому продолжаются исследования генов, кодирующих различные типы рецепторов дофамина при ГРДВ. В то же время с помощью позитронно-эмиссионной томографии было установлено, что перенесенная при рождении ишемия мозга влечет за собой стойкие изменения дофаминовых рецепторов второго и третьего типов в структурах стриатума (Lou Н. С. et al., 2004). В результате этого снижается способность рецепторов связывать дофамин (появляется много «пустых» рецепторов) и формируется функциональная недостаточность дофаминергической системы. Эти результаты были получены при обследовании шести подростков с ГРДВ в возрасте 12—14 лет. Следует отметить, что ранее эти пациенты уже были обследованы теми же авторами — они входили в группу из 27 детей, которые родились недоношенными — на сроках 28—34 недели беременности, и в течение 48 ч после рождения им проводилась позитронно-эмиссионная томография, которая подтвердила гипоксически-ишемическое поражение ЦНС. Затем в возрасте от 5,5 до 7 лет дети прошли клиническое и психологическое обследование, у 18 из них был подтвержден диагноз ГРДВ, у остальных отмечались более серьезные неврологические нарушения. Полученные данные показывают, что критические изменения на уровне рецепторов и, возможно, со стороны других белковых структур, участвующих в обмене нейромедиаторов, могут не только иметь наследственную природу, но и являться результатом преи перинатальной патологии.
Ген DAT1 отвечает за обратный захват дофамина в клетку, из которой он ранее был высвобожден. Это существенный этап обмена дофамина, поскольку именно на этом уровне оказывает свой терапевтический эффект метилфенидат — широко известный препарат, применяемый при лечении ГРДВ за рубежом. Метилфенидат блокирует белок — переносчик дофамина, снижая тем самым обратный захват дофамина и увеличивая его содержание в синапсе. DAT1 — ген, контролирующий белок — переносчик дофамина, имеет участок 3 (его функциональное значение остается невыясненным), содержащий повторы из 40 нуклеотидных пар, число которых может варьировать от 3 до 13 копий. Аллельный вариант гена DAT1, ассоциированный с ГРДВ, отличается длиной данного участка, значительно превышающей обычно встречающуюся, — число повторов в нем составляет 10 или 9. Показано, что при таком варианте гена происходит увеличение на 70% активности белка — переносчика дофамина, влекущее за собой снижение содержания дофамина в синапсе, что, в свою очередь, обусловливает как импульсивность, так и нарушения внимания, присущие ГРДВ.
Для ГРДВ характерно снижение активности дофаминергической системы мозга. Дефицит дофамина приводит к нарушениям работы кортико-стрио-таламических контуров, обеспечивающих сенсомоторные и когнитивные функции (Castellanos F. X., 1997). Между тем, перечень генов, которые могут определять предрасположенность к ГРДВ, постоянно пополняется, хотя их значимость в патогенезе ГРДВ может существенно различаться. В этот перечень включены некоторые гены, регулирующие работу норадренергической системы, серотонинергической системы, механизмы нейромедиаторной передачи, нейрональной пластичности, нейроонтогенеза (табл. 6.2) (Adler L. A. et al., 2015).
Продолжаются интенсивные генетические исследования ГРДВ, что должно привести к открытию новых генов предрасположенности к ГРДВ. Кроме того, результаты этих исследований будут способствовать выяснению роли таких генов для нормальной работы мозга. Еще одна важная перспектива состоит в том, что специфические проявления клинических вариантов ГРДВ удастся связать с влиянием определенных генов, что позволит более направленно осуществлять подбор лекарственных препаратов и вести поиск новых средств лечения ГРДВ.
Таким образом, важной причиной ГРДВ является наследственная предрасположенность. Вместе с тем известно, что в основе развития многих случаев ГРДВ лежат повреждения развивающегося мозга в периоды беременности и родов (преи перинатальные патологические факторы), приводящие к нарушениям морфофункционального онтогенеза ЦНС.