Адсорбционные слои нерастворимых ПАВ

В самом общем случае в адсорбционном слое действуют как силы отталкивания, так и силы межмолекулярного притяжения. Поскольку энергия межмолекулярного притяжения углеводородных цепей растет с увеличением их длины, очевидно, что наиболее сильные эффекты межмолекулярного взаимодействия должны проявляться для длинноцепочечных, практически нерастворимых ПАВ. Действительно, основные представления… Читать ещё >
Адсорбционные слои нерастворимых ПАВ (реферат, курсовая, диплом, контрольная)
Для исследования строения адсорбционных слоев, образованных нерастворимыми ПАВ, Ленгмюром был сконструирован прибор, позволяющий с необходимой точностью измерить двухмерное давление адсорбционных слоев нерастворимых ПАВ (рис. II-13). На поверхности плоской кюветы с парафинированными стенками находится легкий плавающий барьер, соединенный с динамометром (весами). В современных вариантах прибора преимущественно используют кюветы из фторопласта и чувствительные автоматические силоизмерительные системы.
Чтобы предотвратить миграцию молекул ПАВ из рабочей области, зазор между измерительным прибором и стенками прибора перегораживают тонкими золотыми листочками или парафинированными нитками. Второй барьер, который можно передвигать, служит для изменения площади рабочей поверхности прибора. Малое количество очень разбавленного раствора ПАВ в легколетучем растворителе наносят на поверхность воды между измерительным и вспомогательным барьерами. Например, растворением 1 мл сантимолярного бензольного раствора цетилового спирта в 1000 мл высокоочищенного бензола готовят 10~5 М раствор цетилового спирта. При этом 0,1 мл такого раствора ПО-9 моль ПАВ) на площади 100 см2 отвечает адсорбции 10_7моль/м2, чтосоставляет ~1% от предельной адсорбции Гта*.
Адсорбцию можно изменять, передвигая вспомогательный барьер и тем самым меняя площадь, на которую нанесено заданное коли;
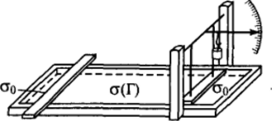
Рис. II-13. Схема прибора Ленгмюра для измерения двухмерного давления адсорбционных слоев нерастворимых ПАВ.
чество ПАВ. После испарения летучего растворителя уравновешивают силу F, действующую на измерительный барьер. Полученное значение Fделят на ширину барьера и находят двухмерное давление я. Повторяя измерения при разных значениях адсорбции (разных количествах нанесенного раствора и разных положениях вспомогательного барьера), получают зависимость двухмерного давления я от адсорбции Г (или от площади на молекулу в адсорбционном слое sM).
Объектами исследований, проведенных Ленгмюром и его последователями (Н. Адам, Е. Райдил и др.), служили многочисленные вещества как низкомолекулярные — высшие гомологи кислот, спиртов, аминов, так и высокомолекулярные, в том числе белки и нуклеиновые кислоты. Результаты этих исследований подробно изложены в [4]. Показано, что для широкого круга веществ при Г -? 0 произведение Я5М площади, приходящейся на молекулу в адсорбционном слое, на двухмерное давление действительно стремится к к Г, независимо от строения молекул ПАВ.
При более высоких значениях адсорбции (меньших величинах площади, приходящейся на молекулу ПАВ) начинают проявляться эффекты, связанные с взаимодействием молекул ПАВ в адсорбционном слое — их взаимным притяжением и отталкиванием (собственным размером молекул ПАВ). Если притяжение молекул выражено слабо, то зависимость двухмерного давления от площади на молекулу может быть описана предложенным Фольмером выражением.

аналогичным уравнению идеального газа с введенной поправкой на собственный объем молекул[1]. При этом, однако, рост двухмерного давления при сжатии адсорбционного слоя ограничен некоторой величиной я^, которая называется давлением коллапса (рис. II-14). При я^ адсорбционный слой теряет устойчивость, на его поверхности образуются складки, подобные торосам на ледяных полях (рис. II-15), и возникают полимолекулярные слои.
Предельное значение площади на молекулу может рассматриваться как собственное сечение молекулы ПАВ; для некоторых классов ПАВ эта величина приблизительно одинакова и не зависит от длины цепи (это подтверждает высказанное выше соображение о вертикальной ориентировке молекул в таком плотном адсорбционном.
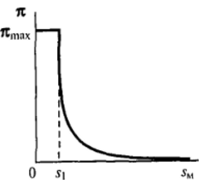
Рис. II-14. Изотерма двухмерного давления я (5и) в области сильного сжатия адсорбционного слоя.
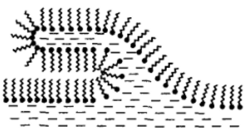
Рис. II-15. Схема потери устойчивости адсорбционным слоем при я = я
слое). Независимость же этой величины и от природы полярной группы свидетельствует о том, что она определяется сечением углеводородной цепи.
Для определения s 1 из экспериментально полученной зависимости двухмерного давления от площади на молекулу в поверхностном слое экспериментальные данные удобно представить в координатах я.su — я. В отсутствие заметных сил притяжения между молекулами экспериментальные данные в этих координатах ложатся на прямую линию (рис. II-16), угол наклона которой дает значение площади на молекулу в плотном адсорбционном слое, а точка пересечения с осью ординат отвечает кГ= 4 мН • м'1 • нм2.
Если молекулярная масса М исследуемого вещества неизвестна, то, используя навеску т, нельзя рассчитать значения адсорбции Г в единицах моль/м2, а следовательно, и площадь на молекулу Sm. Тогда по оси абсцисс вместо произведения я$м откладывается произведение.
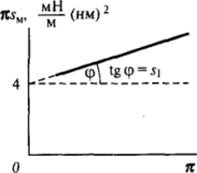
Pec. II-16. Изотерма Я5"(я) с учетом сил отталкивания
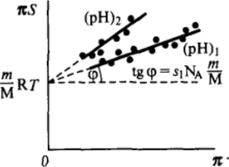
Рнс. II-17. К определению молекулярной массы М, и площади $" занимаемой молекулой, по изотерме яS (x)
двухмерного давления на макроскопическую площадь между барьерами S.
Уравнение (11.19) в этом случае можно записать в виде.
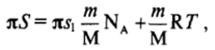
т. е. результаты измерений должны ложиться на прямую в координатах — я (рис. II-17). Экстраполяцией этой прямой до оси ординат получают молекулярную массу М исследуемого вещества, а из тангенса угла наклона прямой находят затем площадь sl9 приходящуюся на молекулу в плотном адсорбционном слое.
Такая методика исследования применялась для определения молекулярной массы белков и нуклеиновых кислот и для изучения их строения в адсорбционном слое. Этот метод позволяет получить ценные сведения о конформации молекул в поверхностном слое, поскольку эта последняя определяет величину площади, занимаемую ими в двухмерной пленке. Чтобы не вводить поправку на взаимное притяжение молекул в адсорбционном слое, эти измерения проводят в той области значений pH, в которой молекулы заряжены вследствие ионизации. Конформация белка зависит от pH среды, которое определяет диссоциацию ионогенных групп и их гидратацию[2]. При изменении pH изменяется и наклон прямых зг5м(я), т. е. величина s (рис. II-17).
При сжатии пленок, образованных глобулярными белками (например, альбумином, глобулином, гемоглобином, трипсином и др.), вплоть до давления ~ 20 мН/м изотермы двухмерного давления вполне обратимы. При несколько большем сжатии пленок, когда площадь на одну аминокислотную группу составляет — 0,17 нм2, двухмерное давление резко возрастает и в пленках происходят необратимые изменения. Они могут приобретать специфическую нерастворимость и своеобразные структурно-механические (реологические) свойства [8]. Более сильное сжатие пленок (до 0,05—0,1 нм2 на группу) приводит к их коллапсу — образованию складок (а возможно, и полимолекулярных слоев) и отрыву их от поверхности.
Следует отметить, что многие белки сохраняют в монослоях свои ферментативные свойства и могут вступать в специфические реакции. Поэтому описываемые коллоидно-химические методы исследования пленок белков в совокупности с другими ценны для изучения различных свойств белков и открывают путь к раскрытию механизма процессов обмена на границах раздела клеток и внутриклеточных структур в биологических объектах. Именно на таких границах происходит (в силу поверхностной активности) концентрирование биологически и физиологически активных веществ, проявляющих здесь свои важные специфические свойства (например, ферментативную активность).
В самом общем случае в адсорбционном слое действуют как силы отталкивания, так и силы межмолекулярного притяжения. Поскольку энергия межмолекулярного притяжения углеводородных цепей растет с увеличением их длины, очевидно, что наиболее сильные эффекты межмолекулярного взаимодействия должны проявляться для длинноцепочечных, практически нерастворимых ПАВ. Действительно, основные представления о строении и свойствах адсорбционных слоев, в которых существенно молекулярное притяжение углеводородных цепей молекул ПАВ, были развиты на основе изучения адсорбционных слоев с помощью весов Ленгмюра. Оказалось, что адсорбционные слои не только могут давать состояния, аналогичные известным для объемных фаз, но и обнаруживают и некоторые иные, не имеющие аналогов в объемных фазах. В настоящее время не существует общепринятой классификации, которая охватывала бы все возникающие в плотных адсорбционных слоях состояния, а также достаточно полно обоснованные представления об их природе.
А. Адамсон [4] различает следующие типы поверхностных пленок.
- 1. Газообразные (7-пленки, которые приближенно подчиняются уравнению состояния идеального двухмерного газа (11.18) или газа с молекулами конечного размера (рис. 11−18). Такие пленки образуют, например, жирные кислоты при низких значениях двухмерного давления или достаточно высоких температурах. Иногда выделяют еще парообразные пленки при температурах ниже температуры конденсации адсорбционных слоев (см. далее).
- 2. Жидкорастянутыепленки, для которых площадь на молекулу обычно изменяется в интервале от 0,4—0,5 до 0,22 нм2 при повышении двухмерного давления от очень малых величин (десятые, сотые доли мН/м) до нескольких мН/м. На рис. 11−19 приведены изотермы двухмерного давления пентадециловой кислоты, снятые при различных температурах (указаны на кривых, °С). Жидкорастянутые пленки образуют многие вещества, в частности кислоты, с не очень большой длиной цепи при повышенных двухмерных давлениях. Особенно характерно образование жидко-растянутых пленок для веществ с разветвленной цепью. В таких пленках площадь на молекулу значительно выше площади сечения углеводородной
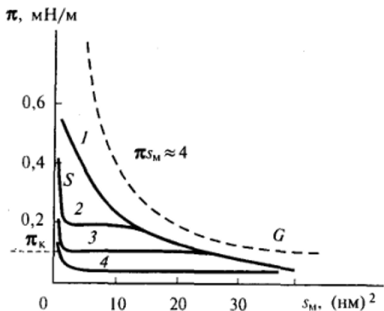
Рис. II-18. Изотермы двухмерного давления для ряда жирных кислот:
- 1— лауриновой (С12); 2— миристиновой (С14); 3— пентадецкловой (С"); 4— пальмитиновой
- (С J
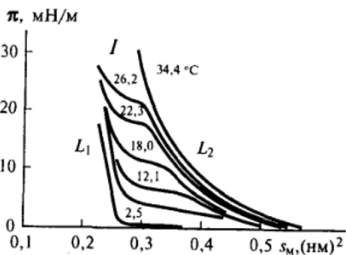
Рис. II-19. Изотермы двухмерного давления я ($и) адсорбционных слоев пентадециловой кислоты при разных температурах цепи. Вместе с тем в них углеводородные цепи, несомненно, находятся в конденсированном состоянии, образуя пленку, толщина которой меньше длины цепи молекул ПАВ и увеличивается с ростом двухмерного давления. Образование такого состояния, не имеющего объемного аналога, может быть связано с взаимным притяжением углеводородных цепей при одновременном умеренном отталкивании полярных групп.
3. Жидкие L -пленки, для которых характерны малые сжимаемости (резкий подъем кривых я — sj; экстраполяция кривой я (5м) на нулевое двухмерное давление дает для них значение s ~ 0,22 нм2, что лишь ненамного выше сечения углеводородной цепи молекулы ПАВ. Эти пленки образуются из жидкорастянутых при высоких значениях двухмерного давления. Такие вещества, как высшие жирные кислоты (начиная с тридециловой), дают при повышенных температурах жидкие пленки без образования жидкорастянутых. ПАВ с большой по размеру полярной группой (например, фенолы) дают жидкие пленки, в которых площадь на молекулу превосходит 0,22 нм2.
Между жидкими и жидкорастянутыми состояниями может существовать переходная область сравнительно высокой сжимаемости, которая отвечает так называемым промежуточным пленкам (см. рис. II-19 участок /кривых); природа этого состояния не вполне ясна.
4. Твердые, или S-пленки, сжимаемость которых еще ниже, чем у жидких; предельное значение площади на молекулу при экстраполяции на нулевое двухмерное давление составляет для них 0,206 нм2. Наиболее важные отличия твердых поверхностных пленок обнаруживаются при сопоставлении их реологических свойств. В жидких пленках течение происходит уже при малых напряжениях сдвига (см. гл. IX) и скорость сдвига линейно связана с напряжением, тогда как твердые пленки способны выдержать значительные напряжения сдвига без остаточной деформации и затем разрушаются. Качественным тестом, позволяющим различать жидкие и твердые адсорбционные пленки, может служить метод сдувания: поверхность жидкости, несущая адсорбционный слой, посыпается тонким порошком (обычно тальком), и на нее под углом направляется струя воздуха. При этом в случае жидких поверхностных слоев заметно движение частиц, тогда как на твердых этого не происходит, но иногда наблюдается откалывание отдельных больших «льдин», которые движутся как единое целое.
Рассмотрим более подробно переходы между пленками различных типов и влияние на них температуры, строения молекул ПАВ, состава среды. Непосредственный переход от газообразных (парообразных) пленок к жидким и твердым конденсированным пленкам представляет собой двухмерный фазовый переход первого рода, вполне аналогичный трехмерной конденсации паров. Уменьшение площади на молекулу в адсорбционном слое в области парообразных пленок ведет к постепенному повышению давления, вплоть до давления конденсации насыщенного двухмерного пара як (см. рис. II-18). После этого сжатие пленки не сопровождается увеличением двухмерного давления — происходит конденсация двухмерного пара в двухмерное конденсированное состояние: жидкорастянутое, жидкое или твердое в зависимости от природы ПАВ, температуры, а в ряде случаев и от состава подстилающего раствора (в частности, от значения pH).
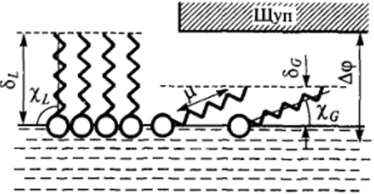
Рис. IK-20. Схема строения адсорбционного слоя ПАВ в области двухмерной конденсации (схема опытов А.Н. Фрумкина).
Правильность такой интерпретации изотерм двухмерного давления в области постоянных значений двухмерного давления была подтверждена А. Н. Фрумкиным при изучении особенностей поверхностного электрического потенциала в области конденсации.
Следующие упрощенные рассуждения показывают связь между скачком потенциала у поверхности и строением адсорбционного слоя. Будем рассматривать молекулы ПАВ как диполи с дипольным моментом ц, расположенные под углом х к поверхности раздела фаз, а пленку в целом — как электрический конденсатор с эквивалентной диэлектрической проницаемостью б (рис. II-20). Общий удельный (на единицу поверхности) дипольный момент пленки равен.
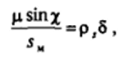
где р, — плотность поверхностного заряда; 6 — толщина пленки как плоского конденсатора с удельной емкостью, равной ее,/6; l/sH * TNA — число молекул на единице поверхности. Разность потенциалов Д<�р на обкладках такого конденсатора равна.
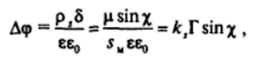
где kt = pNyee,. Таким образом, потенциал адсорбционного слоя, рассматриваемого как конденсатор, зависит от ориентации молекул ПАВ. Изучая зависимость потенциала поверхности от адсорбции, можно получить сведения об изменении ориентации молекул ПАВ при конденсации адсорбционных слоев.
Для измерения потенциала поверхности может использоваться специальный зонд — электрод с нанесенным на его поверхность небольшим количеством радиоактивного изотопа, ионизирующего воздух у электрода. Такой электрод позволяет измерять потенциал поверхности Д<�р с точностью до некоторой постоянной величины. Исследования, проведенные Фрумкиным, показали, что для жирных кислот (рис. 11−21) 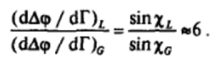
Полагая, что для конденсированного адсорбционного слоя жирной кислоты ориентация молекул ПАВ близка к вертикальной (sinXi «1), получаем для среднего угла наклона молекулы ПАВ в парообразном адсорбционном слое значение ~ 10°, что вполне соответствует утверждению о практически горизонтальном расположении молекул ПАВ в разреженных адсорбционных слоях. При этом в области конденсации передвижение малого по площади электрода — «щупа* вдоль поверхности приводит к резким скачкам измеряемого значения потенциала; это означает, что на поверхности существуют отдельные «островки* конденсированной двухмерной фазы, между которыми находятся участки поверхности, покрытые парообразным адсорбционным слоем. В обеих областях гомогенных ад.
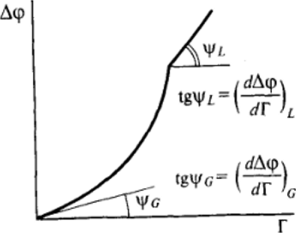
Рис. 11−21. Зависимость разности потенциала А<�р от адсорбции Г при переходе от газообразной к конденсированной пленке сорбционных слоев как при значениях двухмерного давления я ниже давления конденсации я., так и при я > я, таких колебаний значения потенциала при передвижении электрода вдоль поверхности не наблюдается.
Изотерма двухмерного давления при конденсации молекул ПАБ в адсорбционном слое, т. е. при переходе от парообразных к конденсированным пленкам (см. рис. II-18), вполне аналогична по форме изотерме давления реального трехмерного конденсирующегося газа, описываемой уравнением Ван-дер-Ваальса:
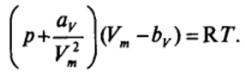
Следуя Фрумкину, можно и для выражения свойств двухмерных адсорбционных слоев применить уравнение вида.
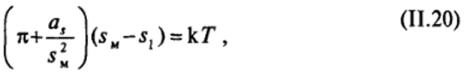
где величина аг, как и характеризует притяжение молекул. Повышение температуры приводит к увеличению давления конденсации насыщенного двухмерного пара и к сужению области конденсации.
Входящая в уравнение (11.20) величина s имеет различные значения в зависимости от природы конденсированного состояния. Для жидкорастянутых пленок, образуемых производными алифатических углеводородов, эта величина составляет обычно — 0,5 нм2. Если при конденсации образуются жидкие пленки, s близка к 0,22 нм2, а для твердых она составляет 0,206 нм2 (для молекул с линейной цепью).
Увеличение длины цепи молекул ПАВ (т. е. усиление притяжения между ними) действует аналогично уменьшению температуры: наблюдается снижение давления конденсации як парообразных пленок при расширении области существования двухфазных и промежуточных состояний (см. рис. И-18). Ионизация полярных групп адсорбированных молекул, например кислот при щелочной реакции воды, на которой образована пленка, напротив, усиливает отталкивание полярных групп и вызывает расширение области газообразного состояния. Растянутыми часто являются пленки, образованные непредельными соединениями (олеиновая кислота) и соединениями с несколькими различными полярными группами в цепи. Наоборот, молекулы триглицеридов образуют конденсированные нерастянутые пленки, площадь на молекулу в которых (0,66 нм2) равна утроенной площади на молекулу ПАВ с одной алифатической цепью.
Чтобы проследить влияние притяжения углеводородных цепей на ход кривых зависимости Я5м(я), представим изотерму двухмерного давления (11.20) в виде.
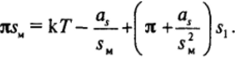
При не очень высоких двухмерных давлениях и соответственно не очень малых площадях на молекулу в адсорбционном слое отклонение произведения Я5М от значения k Тобусловлено в основном описывающим притяжение отрицательным слагаемым — aJsH: кривая Я5м(л) отклоняется вниз от kТ = 4 (рис. 11−22). Для более сильно сжатых (большие значения я) пленок, когда значение 5М приближается к 5i, последнее положительное слагаемое, отвечающее «отталкиванию», может стать достаточно большим по значению, тогда произведение Я5М превышает k Т.
Все сказанное в этом параграфе относится к нерастворимым ПАВ. Как было уже отмечено, растворимые ПАВ, полярная группа которых слабо взаимодействует с водой, содержат углеводородную цепь с малой длиной. Поэтому межмолекулярные взаимодействия цепей имеют для них, как правило, меньшее значение. Только при достаточно большой длине цепи, например для изученной Фрумкиным лауриновой кислоты, наблюдаются ощутимые отклонения от изотермы Шишковского.
Лауриновая кислота имеет растворимость достаточно высокую, чтобы можно было производить измерения зависимости поверхностно.
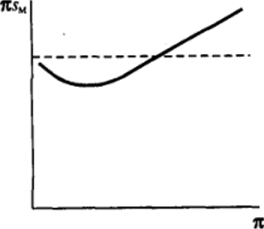
Рис. 11-22. Изотермы я$"(я) при наличии притяжения и отталкивания молекул в адсорбционном слое.
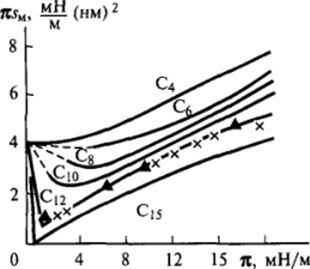
Рис. 11−23. Изотермы Я5м(я) для адсорбционных слоев ряда жирных кислот, полученные по измерениям двухмерного давления методом Ленгмюра (для С", С") и по измерениям поверхностного натяжения (для С4 — С").
ного натяжения от концентрации раствора; вместе с тем ее растворимость и, главное, скорость растворения достаточно низки, чтобы (при быстрой работе) можно было изучать свойства образуемых ею адсорбционных слоев с помощью весов Ленгмюра. Это позволило Фрумкину провести полное сопоставление хода кривых гом(я) для одного и того же вещества по данным, полученным обоими методами, относящимися к растворимым и нерастворимым веществам. Как показывают приведенные на рис. 11−23 экспериментальные кривые, оба метода дают хорошо совпадающие результаты, которые согласуются с результатами изучения этими двумя методами других кислот: содержащих более 12 атомов углерода по методу Ленгмюра и короткоцепочечных гомологов по зависимости а©.
Хорошее соответствие этих двух серий кривых можно считать убедительным доказательством того, что свойства адсорбционных слоев растворимых и нерастворимых ПАВ близки и не связаны непосредственно с растворимостью молекул ПАВ в подстилающей жидкости.
Все рассмотренное выше касалось свойств адсорбционных слоев, образованных одним поверхностно-активным веществом; вместе с тем большое значение как в природных процессах, так и в технике, где, как правило, используются сложные композиции, имеет адсорбция смесей ПАВ, в том числе растворимых и нерастворимых. Сравнительно просто может быть рассмотрена адсорбция смесей ПАВ в отсутствие сил притяжения между их молекулами в адсорбционном слое для растворов, близких к идеальным. При этом проще всего исходить из аналога выражения (11.12) для условия динамического равновесия между процессами адсорбции и десорбции молекул ПАВ. Очевидно, что присутствие на поверхности посторонних молекул не может повлиять на кинетику десорбции рассматриваемого /-го компонента, но будет влиять на скорость его адсорбции, поскольку она пропорциональна доле поверхности, свободной от ПАВ. Для каждого из компонентов доля занятой им поверхности 0, равна произведению числа молекул на единицу площади r, NA на сечение молекулы s": 0, ** T, N* = Г/Г<�вш), где предеьная адсорбция /-го компонента. Общая доля занятой всеми ПАВ поверхности равни сумме величин 0, для всех компонентов. Поэтому для случая п поверхностно-активных компонентов условие равенства скоростей адсорбции и десорбции /-го комп чснта, аналогичное выражению (11.12), принимает вид:
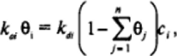
где км, и с, — константы адсорбции и десорбции и концентрация рассматриваемого компонента. Записывая подобные выражения для всех компонентов, после преобразования нетрудно получить обобщенное уравнение Ленгмюра:
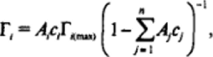
где и At — отношения констант адсорбции и десорбции, т. е. адсорбционные активности соответствующих компонентов.
Если для первых j компонентов известны значения равновесной объемной концентрации, а для остальных — только значения адсорбции (нерастворимые ПАВ), можно воспользоваться преобразованием, предложенным В.В. Кротовым[3]; для рассматриваемого случая ПАВ с разными значениями предельной адсорбции такое преобразование дает, например, для первого компонента выражения вида:
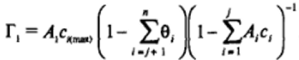
Им же (для случая смеси ПАВ с одинаковой предельной адсорбцией было получено выражение для двухмерного давления вида:
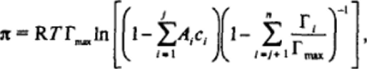
причем, как и в предыдущем выражении, первые / компонентов рассматриваются как растворимые, а остальные как нерастворимые.
Вместе с тем, исследования смешанных адсорбционных слоев нерастворимых ПАВ показывают, что в них могут проявляться сильные эффекты отклонения от идеальности — вплоть до полного разделения взаимно несмешивающихся адсорбционных слоев, что особенно характерно при адсорбции смесей некоторых высокомолекулярных ПАВ.
Подобно объемным конденсированным фазам, адсорбционные слои обладают определенными механическими свойствами, отвечающими их фазовому состоянию. Для изучения механических свойств адсорбционных слоев может использоваться мето;
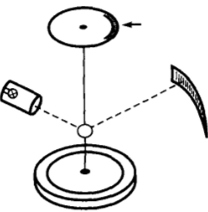
Рис. 11-24. Схема прибора для изучения механических свойств адсорбционных слоев
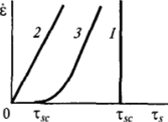
Рис. Н-25. Зависимость е (т,) при различном механическом поведении адсорбционных слоев.
дика крутильного подвеса (рис. 11−24). На поверхность воды, покрытую адсорбционным слоем, помещают диск, подвешенный на тонкой упругой нити. Диск располагается в центре цилиндрической кюветы либо окружен кольцом с постоянным зазором между диском и кольцом. Закрутив лимб, к которому прикреплен верхний конец нити (или повернув кювету), создают заданное усилие на краю диска. Ход деформации, обнаруживаемой при этом в адсорбционном слое в зазоре между кольцом и диском, измеряется, например, по шкале, на которую падает зайчик от зеркальца, закрепленного на диске. Можно использовать и другой режим: вращать с заданной постоянной скоростью кювету (внешнее кольцо) и по углу закручивания нити измерять усилие сдвига, возникающее на периферии диска (см. IX. 1).
Исследования механических свойств адсорбционных слоев, образованных молекулами ПАВ различной природы, показали, что конденсированные адсорбционные слои действительно могут находиться как в твердом, так и в жидком состоянии. Твердые адсорбционные слои (рис. II-25, прямая 1) не обнаруживают необратимых деформаций вплоть до определенных предельных нагрузок тх, после чего происходит их разрушение.
При жидкообразном состоянии адсорбционных слоев сдвиг происходит при любой малой нагрузке (прямая 2); скорость сдвига е пропорциональна действующему усилию xs (углу закручивания нити). Это позволяет оценить поверхностную вязкость адсорбционного слоя, которая сильно зависит от природы ПАВ. Адсорбционные слои могут показывать и более сложное реологическое поведение (см. гл. IX), промежуточное по характеру между жидкостью и твердым телом (кривая 3).
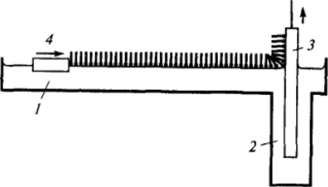
Рис. 11-26. Схема перенесения пленок на твердую поверхность по методу Ленгмюра — Блоджетт
Как показали исследования В. Н. Измайловой с сотр., реологические свойства адсорбционных слоев высокомолекулярных ПАВ играют важную роль в обеспечении устойчивости дисперсных систем, стабилизированных такими слоями (см. гл. VII и VIII).
Большие возможности для исследования строения адсорбционных слоев нерастворимых ПАВ, а в последнее время и перспективным направлением их практического использования, открывает разработанный Ленгмюром и Блоджетт способ перенесения адсорбционных слоев на твердую поверхность с образованием пол и молекулярных слоев Ленгмюра — Блоджетт. В этом случае с одной стороны ванны Легмюра Уделается углубление 2(рис. 11−26); в него опускается пластинка J, которую можно опускать или поднимать с помощью электромотора. После нанесения на поверхность воды слоя ПАВ одновременно с равной скоростью подвижным барьером 4 поджимается адсорбционный слой и поднимается (или опускается) пластинка; при этом адсорбционный слой переходит на поверхность. Перенос адсорбционного слоя осуществляется при постоянном, достаточно высоком значении двухмерного давления, которое обычно контролируется с помощью пластинки Вильгельми (на рисунке не изображена); можно сказать, что адсорбционный слой принудительно «выжимается» с поверхности раствора на поверхность пластинки. Подобную операцию можно повторять многократно, перенося на поверхность большое количество адсорбционных слоев (иногда несколько сотен).
Если пластинка поочередно движется вверх-вниз, то образуются полимолекулярные пленки, в которых соседние монослои поочередно контактируют углеводородными цепями и полярными группами — пленки типа Y (рис. 11−27, б). Если нанесение слоев всегда проводится при движении пластинки в одну сторону, то могут образовы;
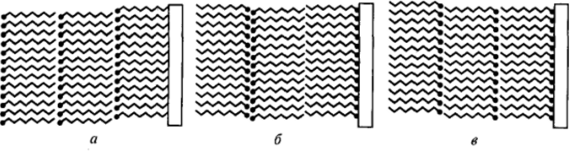
Рис. 11−27. Схема строения пленок Ленгмюра — Блоджетт: а — пленки типа X; б — пленки типа Y; в — пленки типа Z.
ваться «полярные» (с нескомпенсированным в соседних слоях дипольным моментом молекул ПАВ) пленки, в которых полярные группы одного монослоя контактируют с углеводородными цепями другого. Если нанесение осуществляется на гидрофобную поверхность при движении ее вниз, возникают Х-пленки (рис. 11−27, а); иногда, впрочем, при попытках получения таких пленок возникают Y-пленки, т. е. в момент перенесения молекулы ПАВ переворачиваются. При нанесении полислоев на гидрофильную поверхность при ее движении вверх удается получать (также не всегда) пленки Z-типа (рис. П-27, в).
Методом Ленгмюра — Блоджетт удается формировать структуры с заданной молекулярной организацией, в которых последовательные слои имеют разный, напёред заданный состав. Так, при использовании практически нерастворимых в воде органических кислот с достаточной длиной цепи, например стеариновой, состав переносимых слоев можно изменять, меняя электролитный состав подстилающего раствора — вводя многозарядные ионы, образующие с кислотами нерастворимые в воде соли. Для организации такого запрограммированного перенесения адсорбционных слоев разного состава сконструированы ванны Ленгмюра — Блоджетт с несколькими отделениями, в которые поочередно опускается пластинка.
Среди различных перспективных направлений использования пленок Ленгмюра — Блоджетт можно выделить применение их в качестве монохроматоров и анализаторов мягкого (длинноволнового) рентгеновского, нейтронного и других излучений: это основано на организации на заданных больших расстояниях (несколько нм) слоев сильно рассеивающих излучение тяжелых ионов. Много внимания уделяется также получению светопроводящих, электропроводящих и сверхпроводящих тонких пленок на поверхности твердых тел как основы ряда новых электронных приборов.
по.
- [1] Сходное по форме выражение может быть получено, если логарифмический сомножитель уравнения (11.16) преобразовать к виду —1п (1 — Г/Г,^) и разложить в ряд с использованием приближения
- [2] Овчинников Ю. А. Биоорганическая химия. М.: Просвещение, 1987.
- [3] В. В. Кротов. Коллоидный журнал, 1985, т. 47, № 6. С. 1075—1083.