Принципы классической статистики

Такая модель при наличии ЭВМ возрождает мысль о расчете движения каждой из молекул в любой момент времени. Это предполагает, что система ведет себя однозначно, подчиняясь динамическим закономерностям. Однако если бы такой расчет и удался, мы не успели бы его даже осознать, как он потерял бы всякий смысл: при нормальных условиях одна молекула совершает ~Ю9 столкновений в секунду, а в 1 см3… Читать ещё >
Принципы классической статистики (реферат, курсовая, диплом, контрольная)
О том, что вещество состоит из атомов, догадывались еще древние греки, но научное обоснование этого предположения появилось лишь в XVII— XVIII вв. в связи с изучением химических реакций.
Пусть в какой-то момент времени известны координаты и импульсы всех молекул газа, т. е. микросостояние системы. Тогда законы динамики позволяют, казалось бы, рассчитать его для следующего момента времени, затем следующего и т. д. Это и лежало в основе мысли французского математика П. Лапласа (1749—1827) о предопределенности судьбы Вселенной: ее нынешнее состояние — результат предыдущего и основа будущего состояний. Такой расчет позволил бы, в частности, оценивать параметры состояния газа — его объем V, давление р и температуру Т. Они важны для контроля атмосферы Земли, расчета подъемной силы крыла самолета, сопротивления движению транспортных средств, ракет, снарядов и т. д.
Задача, однако, осложняется огромным числом молекул. В одном моле вещества его определяет постоянная Авогадро, названная в честь итальянского физика и химика А. Авогадро (1776—1856): NA = 6,02 • 1023 моль-1. Чтобы вообразить это огромное число, прибегают иногда к образам. Представим, что все молекулы из чаши яда, которую заставили выпить Сократа, равномерно распределились по поверхности Земли. Тогда в каждой чашке чая содержалось бы несколько молекул из той чаши.
При таком количестве частиц динамические расчеты немыслимы. Даже для трех взаимодействующих тел найти законы их движения весьма непросто, и потому физика начала с экспериментов. Благодаря им удалось связать параметры состояния системы эмпирическим уравнением, полученным французским физиком Б. Клапейроном (1799—1864) и русским химиком Д. И. Менделеевым (1834—1907):

где v = т/М = N/NA — количество вещества в молях; R = 8,31 ДжДмоль • К) — молярная газовая постоянная. Это уравнение можно преобразовать к виду.

где п = N/V— концентрация молекул; k = R/NA = 1,38 • 10-23 Дж/К — постоянная Больцмана, названная в честь австрийского физика-теоретика Л. Больцмана (1844—1906). Из формулы (4.2) следуют уравнения изотермического, изобарного и изохорного процессов, а также законы А. Авогадро, Д. Дальтона (1766—1844) и др.
И тем не менее без теории наука развиваться не может, поэтому немецкими физиками А. Кренигом (1822—1879) и Р. Клаузиусом (1822—1888) была предложена молекулярно-кинетическая теория (МКТ), объясняющая поведение газа. В ее основу положены признаки идеального газа:
- 1) расстояния между молекулами много больше их размеров (следовательно, объем, занимаемый молекулами, много меньше объема газа);
- 2) взаимодействие между молекулами на расстоянии отсутствует, а сталкиваются они упруго',
- 3) движение молекул беспорядочно, хаотично, их координаты, а также направления скоростей равновероятны.
Реальный газ близок к идеальному при небольших концентрациях молекул и относительно высоких температурах.
Такая модель при наличии ЭВМ возрождает мысль о расчете движения каждой из молекул в любой момент времени. Это предполагает, что система ведет себя однозначно, подчиняясь динамическим закономерностям. Однако если бы такой расчет и удался, мы не успели бы его даже осознать, как он потерял бы всякий смысл: при нормальных условиях одна молекула совершает ~Ю9 столкновений в секунду, а в 1 см3 находится ~Ю19 молекул! Это означает, что удары молекул мгновенно стирают память о предыдущем состоянии газа и приводят к молекулярному хаосу. Здесь требуются совершенно иные подходы.
Если бросать монету N раз, то из них N раз выпадет «решка», причем величина w = NJN может оказаться любой. Однако если N увеличивать, то значение w будет стремиться к 0,5 — оно характеризует вероятность выпадения «решки». Таким образом, вероятность события определяет ожидаемую частоту его повторения при большом числе испытаний.
Закономерности, основанные на оценке вероятности событий, называются статистическими. Они применимы и к системе молекул.
Пусть сосуд содержит четыре молекулы. Возможные комбинации их распределения по половинам объема сосуда представлены на рис. 4.1. Здесь учтено, что если в левой половине находятся молекулы с номерами 1, 3, а в правой — 2, 4, то это одно микросостояние системы, а если наоборот, то другое. В отличие от этого макросостояние системы определяет лишь число молекул в каждой половине сосуда безотносительно к их номеру. Отсюда ясно: чем больше возможно микросостояний системы молекул при данном ее макросостоянии, тем больше его вероятность, которую называют статистическим весом.
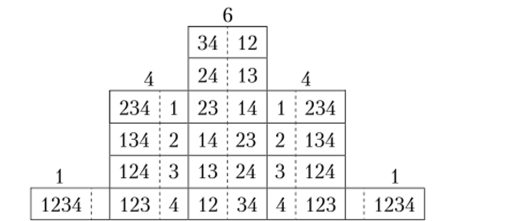
Рис. 4.1.
Из рис. 4.1 следует, что наиболее вероятное распределение молекул по объему сосуда — равномерное, и чем больше в сосуде молекул, тем точнее этот прогноз. В представленном случае нехватка в левой половине сосуда одной молекулы встречается в полтора раза реже, чем точное равенство. Однако если молекул не четыре, а, например, 104 (что гораздо меньше, чем при нормальных условиях), то перекос даже в 5% будет возникать в 1022 (!) раз реже равномерного распределения. Это значит, что статистический хаос является в некоторых отношениях очень точной формой существования материи. В ней проявляется диалектическое единство необходимого и случайного, а также закон перехода количества в качество: слишком большой беспорядок приводит к новому порядку.
Статистические закономерности являются весьма мощным средством анализа, например при измерениях какой-либо физической величины. Ввиду действия многих случайных факторов получить ее точное значение невозможно, однако к нему можно приближаться, увеличивая число измерений и обрабатывая результаты статистическими методами (этому учат в лабораторном практикуме).
Хаотичность движения молекул приводит к соответствующему хаосу импульсов, передаваемых молекулами какой-либо частице. Если ее размер велик (> 5* 10″6 м), то число молекул, ударяющих о ее поверхность, огромно, и потому отклонение векторной суммы импульсов от нуля так же маловероятно, как и отклонение концентрации молекул от равномерного распределения. Если же частица мала, то результирующие импульсы хаотично меняются во времени, вызывая хаотичные перемещения частицы, названные броуновским движением, по имени британского ботаника Р. Броуна (1773—1858), наблюдавшего в микроскоп движение пыльцы растений. Это наглядное доказательство хаотического (теплового) движения молекул, лежащего в основе МКТ.