Соединения серы, селена и теллура

Диоксид серы применяется для получения серной кислоты, а также в бумажной и текстильной промышленности в качестве отбеливающего средства. В пищевой промышленности — для консервирования плодов. Жидкий S02 используется в качестве неводного растворителя для проведения различных синтезов. Na2S203*3H20 применяется в фотографии и медицине. Будучи двухосновной, серная кислота образует два ряда солей… Читать ещё >
Соединения серы, селена и теллура (реферат, курсовая, диплом, контрольная)
Наиболее характерные положительные степени окисления +4 и +6 халькогены проявляют в соединениях с более электроотрицательными элементами: кислородом и галогенами. Более многочисленны кислородсодержащие соединения.
Химический характер оксидов серы, селена и теллура кислотный, о чем свидетельствует их отношение к воде:
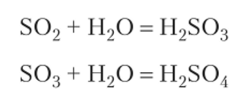
Диоксид серы S02 (сернистый газ) имеет наибольшее значение из соединений серы (1У). В обычных условиях это бесцветный ядовитый газ с характерным резким неприятным запахом жженой серы.
Диоксид серы прекрасно растворим в воде (при обычных условиях около 40 объемов S02 в одном объеме Н20) с образованием сернистой кислоты, соли которой называются сульфитами:
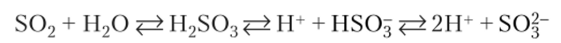
В присутствии щелочи равновесие смещается в сторону образования анионов HS03 и SO3″ При этом образуются сульфиты Me2S03 и гидросульфиты MeHS03:
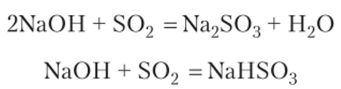
В воде растворяются лишь сульфиты щелочных металлов и гидросульфиты типа Me (HS03)2.
Ион S03" обладает окислительно-восстановительной двойственностью с преобладанием восстановительных свойств:
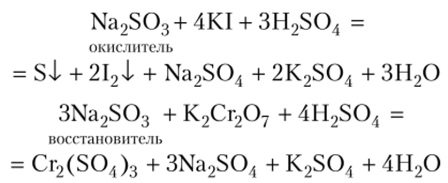
При нагревании сульфиты диспропорционируют: 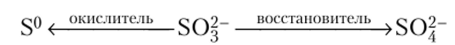
В ряду оксидов Se02 — Те02 наблюдается ослабление кислотных свойств. Se02 легко растворяется в воде, образуя селенистую кислоту H2Se03:
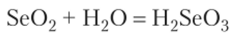
Диоксид теллура (1У) в воде не растворяется, но взаимодействует с растворами щелочей, образуя соли теллуристой кислоты (теллуриты):
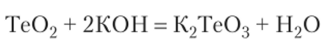
Диоксид же полония со щелочами реагирует только при сплавлении, а с кислотами взаимодействует как основный оксид:
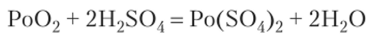
Для полония (1У) характерны солеподобные соединения типа Po (S04)2, Po (N03)4.
Производные ЭО§" называются селенитами и теллуритами. Они похожи на сульфиты.
При действии кислот на селениты и теллуриты выделяются селенистая и теллуристая кислоты.
В отличие от нестойкой H2S03, H2Se03 выделена в свободном состоянии. Это твердое вещество, которое легко теряет воду (при 70°С). Н2Те03 склонна к полимеризации, и поэтому при действии кислот на теллуриты выделяется осадок переменного состава Те02г?Н0.
Оксиды Se02 и Те02 (а также ионы Se03~n Те03_) так же, как и S02 (S03~), обладают окислительно-восстановительной двойственностью:
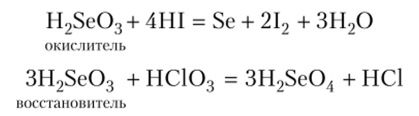
Однако, по сравнению с S02 (и ионами S03~), они проявляют в большей степени окислительные свойства, чем восстановительные:
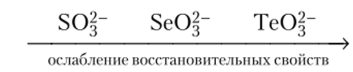
Например, Se02 легко окисляет S02: 
или.
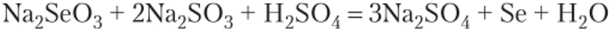
Соединения серы, селена и теллура (). Степень окисления халькогенов +6 проявляется в соединениях с галогенами и кислородом. Соединения полония (У1) неустойчивы.
Оксид серы (У1) S03 получают окислением S02 в присутствии катализатора (платина или оксиды ванадия). S03 при взаимодействии с водой образует серную кислоту:

В водных растворах H2S04 — сильная двухосновная кислота. Растворение в воде сопровождается выделением большого количества тепла за счет образования гидратов. Поэтому смешивать концентрированную H2S04 с водой следует очень осторожно, вливая серную кислоту тонкой струйкой в воду, а не наоборот. Концентрированная серная кислота поглощает пары воды, и поэтому ее применяют в качестве осушителя; она отнимает воду и от органических веществ, обугливая их.
При охлаждении разбавленной серной кислоты выделяются кристаллогидраты. В технике концентрированную серную кислоту (98%-ную) получают растворением S03 в разбавленной II2S04.
В серной кислоте оба иона Н+ и SOf" могут быть окислителями. В разбавленных растворах роль окислителя выполняют ионы Н+, поэтому разбавленная серная кислота окисляет только металлы, стоящие в ряду напряжений до водорода, с выделением Н2. В концентрированных растворах H2S04 окислителем является ион S04_, поэтому она окисляет большинство неметаллов и металлов, восстанавливаясь до различных соединений серы в зависимости от активности и характера восстановителя. Многие металлы (А1, Cr, Fe и др.) она пассивирует, на Ft и Аи не действует:

Например: 
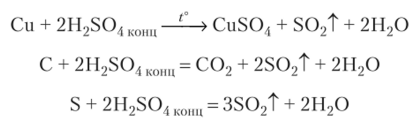
Будучи двухосновной, серная кислота образует два ряда солей: сульфаты и гидросульфаты. Большинство сульфатов хорошо растворимы в воде. Плохо растворимы сульфаты Ва (П), Sr (ll) и РЬ (П). Из водных растворов сульфаты обычно выделяются в виде кристаллогидратов. Соединения типа CuS04-5H20 и FeS04-7H20 называются купоросами.
При кипячении раствора сульфита натрия с порошком серы образуется тиосульфат натрия Na2S203. Свойства гиосульфатов обусловливаются присутствием атомов серы в двух разных степенях окисления (+6 и -2). Соответствующая тиосерная кислота H2S03S:
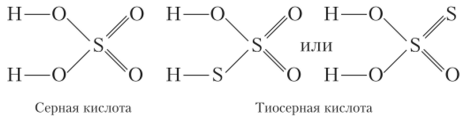
неустойчива и при получении распадается:
Наличие S-2 определяет восстановительные свойства гиосульфат-иона S03S2_:
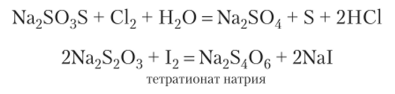
При растворении S03 в концентрированной серной кислоте образуется целая серия полисерных кислот: H2S207 (двусерная (пиросерная) или дисульфат водорода), H2S3O10 (трисерная или трисульфат водорода), H2S04«S03 (нолисерная).
H2S04S03 или H2S207 — пиросерная кислота, соответствующие ей соли — пиросульфаты:

Смесь H2S04, H2S207, H2S3O10, H2S4013 — густая маслянистая, дымящая на воздухе жидкость {олеум) — широко используется в промышленности. Под действием воды связи S—О—S разрываются и нолисерные кислоты превращаются в серную.
Роль мостика, объединяющего тетраэдрические структурные единицы S04, может играть также пероксидная группировка атомов, при этом образуются пероксосоединения.
Пероксодвусерная (надверная) кислота H2S208 получается при электролизе серной кислоты или гидросульфатов. При этом на аноде протекает реакция.
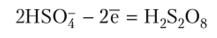
H2S2Os — бесцветные гигроскопические кристаллы, очень сильный окислитель, обугливает бумагу, сахар, парафин. Ее «структурная» формула:
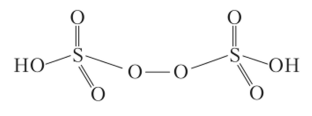
Ее соли — персульфаты (пероксодисульфаты) являются сильными окислителями за счет превращения:
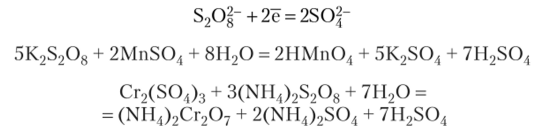
При взаимодействии H2S208 с концентрированным Н202 образуется одноосновная мононадсерная (пероксомоносерная) кислота H2S05:

Соли мононадсерной (пероксомоносерной) кислоты (H2S05) — пероксомоносулъфаты.
Пероксодвусерная кислота H2S208, и пироксомоносерная H2S05 — сильнейшие окислители, при контакте с органическими соединениями (бензол и др.) взрываются.
Пероксодвусерная и иероксомоносерная кислоты гидролизуются с образованием пероксида водорода:
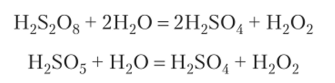
Этим пользуются для получения пероксида водорода в технике.
Пероксосерные кислоты обугливают бумагу, сахар и даже парафин.
Оксид селена Se03 как и S03, с водой взаимодействует, образуя селеновую кислоту.
Триоксид теллура Те03 имеет две модификации. В воде практически не растворяется, но взаимодействует со щелочами с образованием солей соответствующей теллуровой кислоты.
Селенаты по составу, кристаллической структуре и растворимости напоминают сульфаты. Их получают окислением селенидов в щелочной среде, например:
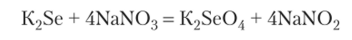
Селеновая кислота H2Se04 — белое кристаллическое вещество (?||Л = 62,4°С). Как и H2S04, она жадно поглощает воду, обугливает органические вещества. В водном растворе это сильная кислота. Из растворов выделяются кристаллогидраты (H2Se04H20, H2Se04-2H20, H2Se04-4H20).
Теллураты содержат анион TeOf- и образуются при сплавлении со щелочами производных Te (IV) в присутствии окислителей.
Теллуровая кислота Н6ТеОе — белое кристаллическое вещество, хорошо растворимое в горячей воде. Теллуровая кислота очень слабая. При нейтрализации Н6Те06 щелочью образуются гидротеллураты, например: МеН5Те06, Ме2Н4Те06. Получены также производные типа Ag6TeOe, Hg3Te06.
Соединения селена (У1) менее устойчивы, чем соответствующие соединения серы (У1). В соответствии с этим H2Se04 — более сильный окислитель, чем H2S04.
Например, H2Se04 окисляет концентрированную соляную кислоту и золото:
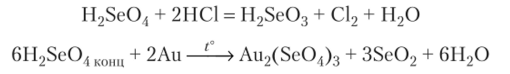
За счет выделения атомарного хлора смесь H2Se04 и 2НС1 — сильнейший окислитель, растворяет золото и платину (подобно царской водке).
Окислительные свойства НГ)Те06 выражены слабее, чем у H2SeO,4.
Применение. Сера применяется в производстве серной кислоты, для вулканизации каучука как инсектицид в сельском хозяйстве и т. д.
Диоксид серы применяется для получения серной кислоты, а также в бумажной и текстильной промышленности в качестве отбеливающего средства. В пищевой промышленности — для консервирования плодов. Жидкий S02 используется в качестве неводного растворителя для проведения различных синтезов. Na2S203*3H20 применяется в фотографии и медицине.
Пероксосульфаты — сильные окислители, используются при проведении химического анализа и синтеза.
Селен и теллур используют как полупроводники для изготовления фотоэлементов оптических и сигнальных приборов. Большая группа селенидов и теллуридов — полупроводники. Это селениды и теллуриды цинка, кадмия и ртути (тип А2В6). Например: ZnS, CdSe, HgTe и др.
Селен используют для получения стекол рубинового цвета и др. Соединения селена и теллура используются для получения разнообразных селенои теллуроорганических соединений.
Изотоп 210Ро (Ту2 = 138,4 дня) применяют как источник а-частиц.
Токсичность элементов. Многие соединения серы, селена и теллура токсичны. Полоний еще опаснее ввиду его радиоактивности. Сера не обладает выраженными токсическими свойствами, но многие ее соединения сильно ядовиты, как, например, сероводород, сероуглерод (СДЯВ), хлорангидриды кислот и т. д. ПДК для сульфид-ионов в воде составляет 0,05 мг/л. Сульфиты натрия и других щелочных металлов очень опасны при попадании внутрь организма за счет выделения сероводорода в желудочно-кишечном тракте. Серная кислота вызывает тяжелые ожоги кожи. Хлорангидриды кислот сильно раздражают слизистые оболочки глаз и дыхательных путей и вызывают ожоги кожи. Селен и его соединения ядовиты и по характеру действия несколько напоминают соединения мышьяка. Селенистая кислота и ее соли действуют сильнее, чем селеновая кислота и ее производные — при попадании на кожу вызывают медленно заживающие раны, а также дерматиты, а оксид селена (1У) — резкую боль, онемение. Органические соединения селена — сильные нервные яды.
Теллур и его соединения в токсическом отношении действуют аналогично неорганическим соединениям мышьяка и селена.