Галогеноводороды.
Общая и неорганическая химия

Бромоводород окисляется с меньшим экзоэффектом (—138 кДж), а в случае НС1 достижение состояния равновесия возможно в реальных условиях. Реакция окисления НС1 может быть использована для сравнения окислительных свойств кислорода и хлора при высоких температурах. Верхняя колба заполнена газообразным HCI. Если в нее ввести несколько капель воды, то HCI растворяется, в колбе создается разрежение… Читать ещё >
Галогеноводороды. Общая и неорганическая химия (реферат, курсовая, диплом, контрольная)
Соединения галогенов с водородом — галогеноводороды — образуются во многих реакциях с участием галогенов: при их взаимодействии с водой, в реакциях с органическими веществами, при гидролизе галогенидов и т. д. Некоторые свойства галогеноводородов приведены в табл. 21.2.
При образовании связи Н-Гал образуется молекула с полярной ковалентной одинарной связью. По мере увеличения главного квантового числа валентного электрона в ряду F -1 размеры его атомной орбитали увеличиваются, а плотность электронного облака уменьшается. В соответствии с этим в ряду HF — Н1 увеличивается межатомное расстояние и уменьшается энергия связи Н — Гал. Уменьшение энергии связи атома.
Величина. | HF. | НС1. | НВг. | HI. |
Д#?т, кДж/моль. | — 271. | — 92. | — 36. | ?27. |
Энергия разрыва связи Н-Гал, кДж/моль. | ||||
Межъядерное расстояние, нм. | 0,092. | 0,127. | 0,141. | 0,161. |
Дилольный момент, D. | 1.91. | 1,03. | 0,79. | 0,42. |
Температура плавления, °С. | — 83. | — 114. | — 87. | — 51. |
Температура, кипения, ®С. | — 85. | — 67. | — 35. | |
Стандартное состояние. | Газ. | Газ. | Газ. | Газ. |
галогена с маленьким атомом водорода происходит в большей мере, чем одинаковых атомов галогенов между собой (рис. 21.2). Следствием этого является резкое падение значений теплоты образования галогеноводородов в ряду HF — HBr, a HI в стандартных условиях образуется из простых веществ уже с поглощением теплоты.
В соответствии с изменением электроотрицательности галогенов полярность связи Н — Гал в ряду HF — Н1 уменьшается.
При стандартных условиях гало геново до роды — бесцветные ядовитые газы с резким удушливым запахом. Температура кипения фтороводорода аномально велика вследствие образования очень прочных водородных связей в жидком HF.
Смещение электронной плотности от водорода в HF еще больше, чем в молекуле воды, и в жидком фтороводороде существуют длинные цепи, образованные за счет водородных связей. Даже в газовой фазе фтороводород заметно ассоциирован, и в зависимости от температуры и давления в парах присутствуют молекулы от (HF): до (HF)* Для остальных галогсноводородов водородные связи нс характерны.
Получение. Существует три основных пути получения галогеноводородов.
1. Прямой синтез из элементов:
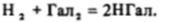 aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">
aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">
Фтор и хлор реагируют с водородом по цепному механизму. Реакции идут практически до конца. Таким способом получают в настоящее время основную долю НС1, сжигая смесь водорода с хлором в специальных горелках.
Бром и иод реагируют с водородом более спокойно, но при температуре взаимодействия получается равновесная смесь газов, и синтезировать таким путем чистые бромои иодоводороды можно только при сравнительно низких температурах (200−250 °С) при избытке водорода с применением гетерогенных катализаторов (Pt).
Рис. 21.2. Изменение энергий связи Гал-Гжл (7) и Н-Гал (2) в ряду F-Cl-Br-I
2. Вытеснение из солей. Газообразные гало геново до роды выделяются при действии кислот на ионные галогениды. При этом существенно, чтобы кислота была нелетуча и не проявляла бы окислительных свойств.
Серная кислота пригодна для получения HF и НС1:
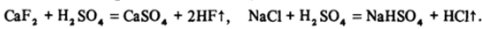
Основное количество фтороводорода получается именно таким путем при переработке фторапатита в фосфорные удобрения. Бромоводород и особенно иодоводород окисляются концентрированной серной кислотой до простых веществ: 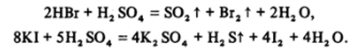
При получении НВг и HI можно использовать фосфорную кислоту, которая практически не проявляет окислительных свойств:
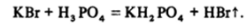
3. Гидролиз галогенидов. Большинство галогенидов неметаллов нацело гидролизуются. Если воды мало, то галогеноводороды выделяются в виде газов:
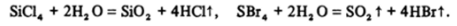
Практически наиболее удобны реакции гидролиза галогенидов фосфора: 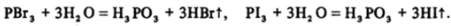
При получении HI специальный синтез Р13 не требуется; на смесь иода с красным фосфором непосредственно воздействуют водой:
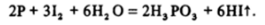
Образующаяся фосфористая кислота не является окислителем, нелетуча, и таким путем можно получить чистый иодоводород.
Свойства. Галогеноводороды очень хорошо растворимы в воде. При комнатной температуре 1 объем воды растворяет «450 объемов НС1 или HI (рис. 21.3). Бромоводород1 растворим еще лучше, a HF смешивается с водой в любых отношениях.
В водных растворах молекулы НГал диссоциируют на ионы Н* и Гал", т. е. их водные растворы являются кислотами. Диссоциации способствуют большая полярность связи Н-Гал и значительная энергия гидратации протона. Кроме того, возможность диссоциации определяется прочностью связи Н-Гал: HF — слабая кислота, тогда как для остальных галогеноводородов константы диссоциации в растворе очень велики и возрастают от НС1 к HI:
HF. | НС1. | НВг. | HI. | |
Есв, кДж/моль. |
|
| 364 1 • 10*. |
|
Раствор HF в воде называется фтороводородной (плавиковой) кислотой, а НС1 — хлороводородной (соляной).
Рис. 21.3. Растворение НС1 в воде
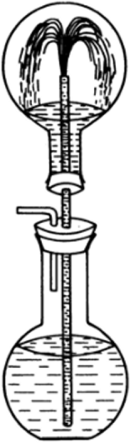
Верхняя колба заполнена газообразным HCI. Если в нее ввести несколько капель воды, то HCI растворяется, в колбе создается разрежение, и вода в нее бьет фонтаном. Подобный эффект наблюдается при заполнении колбы любым хорошо растворимым в воде газом (НГал, NH3).
Ассоциация молекул HF наблюдается и в плавиковой кислоте. Например, в растворе с общей концентрацией 1 моль/л HF концентрация ионов HF2 в 10 раз больше, чем ионов F". Поэтому при нейтрализации плавиковой кислоты на первой стадии образуются гидрофториды:
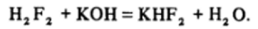
Характерное свойство плавиковой кислоты, так же как и газообразного HF, — легкость взаимодействия с кварцем, стеклом и другими материалами и минералами, содержащими Si02:
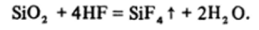
Возможность такой реакции определяется не столько особенностями HF, сколько конкуренцией связей Si-О и Si—F (см. разд. 24.7).
Полярность связи Н-Гал обусловлена переносом электронной плотности с водорода на галоген. Это определяет степени окисления атомов Н*1 и Гал" 1 и в соответствии с этим окислительно-восстановительные свойства молекул. При повышенных (100−200 °С) температурах галогеноводороды легко реагируют с металлами:
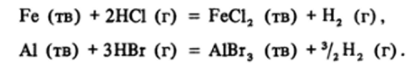
В этих реакциях за счет FF1 галогеноводороды проявляют окислительные свойства. В то же время, за исключением HF, все они могут выступать в роли восстановителей за счет ионов Гал":
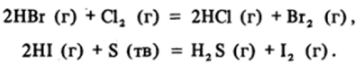
Иодоводород горит в кислороде.
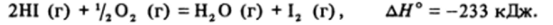
Хотя эта реакция обратима (АН < 0, Av < 0, AS < 0), температура, при которой AG° = 0 и К = 1, столь велика (4000 К), что в реальных условиях равновесие нацело сдвинуто в сторону образования иода и воды.
Бромоводород окисляется с меньшим экзоэффектом (—138 кДж), а в случае НС1 достижение состояния равновесия возможно в реальных условиях. Реакция окисления НС1 может быть использована для сравнения окислительных свойств кислорода и хлора при высоких температурах.
Возьмем две реакции восстановления:

Разность этих реакций.
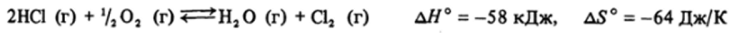
отражает конкуренцию кислорода и хлора как окислителей. Для этого равновесия К — 1 при 890 К, или 600 °C. Ниже 600 °C идет экзотермическое окисление НС1 кислородом, выше — эндотермическое окисление воды хлором. Это равновесие было положено в основу промышленного получения хлора — смесь хлороводорода с воздухом пропускали при * 400 °C над катализатором (CuClj).
Реакция фтороводорода с кислородом HF + 02 +=*? F2 + Н20 сильноэндотермична (АН° = +300 кДж), и равновесие окисления HF нацело сдвинуто влево практически при любых температурах.
В водных растворах, как это видно из значений Ка, галогеноводороды (кроме HF) полностью диссоциированы на ионы. Ионы Гал" обладают только восстановительными свойствами, которые (см. значения Е°) возрастают от СГ к Г. Например, ион I" легко окисляется некоторыми ионами металлов:
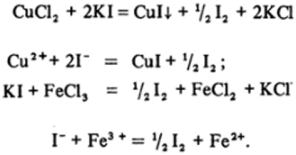
Поэтому многие иодиды металлов не могут существовать в водных растворах.
или или.