Гибридизация атомных орбиталей

Три гибридные 5р2-орбитали располагаются на плоскости под углом 120° друг к другу. Четыре гибридные яр3-орбитали образуют пространственное тело — тетраэдр с углами между орбиталями 109°28'. Часто в молекулах имеются орбитали, занятые электронной парой («неподелейная электронная пара»). Такие орбитали не принимают участия в образовании химических связей, но влияют на геометрию молекулы1… Читать ещё >
Гибридизация атомных орбиталей (реферат, курсовая, диплом, контрольная)
При образовании химических связей может происходить важное явление, которое называется гибридизацией орбиталей.
Рассмотрим атом бериллия Ве. Его электронная формула Ве: 1л22л2.
Судя по тому, что в атоме бериллия нет неснаренных электронов, такой атом не может образовывать ковалентных химических связей и должен вести себя химически подобно инертным газам — не вступать в химические взаимодействия. Но на практике бериллий ведет себя как активный металл и образует множество химических соединений.
Для объяснения такого поведения бериллия рассмотрим электронографическую диаграмму атома бериллия (рис. 2.5).
Из диаграммы очевидно, что атом бериллия кроме заполненной 25-орбитали имеет еще три свободных 2/?-орбитали. С учетом этого электронная формула бериллия должна записываться в виде Ве: 1л22л22р°. Поскольку главное квантовое число для внешнего энергетического уровня атома бериллия одинаково, то разность энергий АЕмежду 2л* и 2р-орбиталями невелика. Экспериментально установлено, что она меньше той энергии, которая высвобождается при образовании химической связи. Поэтому вступающий во взаимодействие атом бериллия стремится перестроить свои орбитали для достижения энергетически выгодного конечного состояния. Для такой перестройки используется кинетическая энергия взаимодействующих с данным атомом частиц.
В результате такой перестройки атом бериллия переходит в возбужденное состояние Ве*, в котором его электронная формула принимает вид Ве*: 1л22л12р1. Переход одного электрона с орбитали 2л на орбиталь 2р обусловлен выполнением для возбужденного состояния атома бериллия правила Гунда. Возникающая при возбуждении конфигурация электронных орбиталей оказывается неустойчивой, поскольку после возбуждения равные по энергии ли р-орбитали имеют различную геометрическую форму. Это приводит к тому, что орбитали возбужденного уровня трансформируются (гибридизируются) к одной форме, которую называют д-орбиталью.
Гибридизация — перестройка электронной структуры атома, при которой происходит выравнивание энергии нескольких типов орбиталей и возникают орбитали нового типа (^-орбитали).
При этом количество образовавшихся гибридных орбиталей равно количеству орбиталей, принявших участие в процессе гибридизации, вне зависимости от их типа (л, р, с1):
V* + V, = V*;
На языке волновых функций это описывается уравнением, связывающим гибридную волновую функцию получившихся орбиталей !(/ с волновыми функциями исходных орбиталей. Графически для ли р-орбиталей процесс гибридизации изображен следующей диаграммой (рис. 2.6).
Отметим, что с этой точки зрения энергия, необходимая для гибридизации (?ги6[)), меньше, чем разница энергий гибридизирующихся орбиталей АЕ. В названии гибридных орбиталей сохраняются названия исходных орбиталей. Так, в данном случае (атом Ве), гибридизируются одна ли одна.
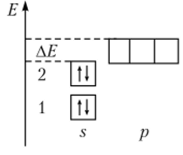
Рис. 2.5. Электронографическая диаграмма атома бериллия.
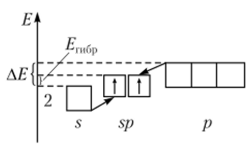
Рис. 2.6. Процесс гибридизации для и /7-орбиталей.
р-орбиталь, и обе ?/-орбитали называются зр-орбиталями. Необходимость гибридизации только двух орбиталей из четырех, имеющихся на втором энергетическом уровне, связана с тем, что у атома бериллия на этом энергетическом уровне только два электрона.
В общем случае гибридизации подвергается то количество орбиталей, которое необходимо для образования наиболее энергетически выгодного конечного состояния взаимодействующих атомов. В случаях, когда в гибридизации участвуют несколько одинаковых орбиталей, их количества при записи названия орбитали отмечаются показателем степени. Например, при гибридизации одной 5- и двух р-орбиталей получаются три зр2-орбитали, а при гибридизации одной 5- и трех р-орбиталей — четыре $р3-орбитали. В рассматриваемом примере с атомом бериллия в результате гибридизации он получает два неспаренных электрона и способность образовывать две ковалентные химические связи. Это полностью соответствует экспериментальным данным, но химии соединений бериллия.
Гибридные орбитали, образованные 5-, ри ?-орбиталями, мало отличаются по форме и выглядят как «несимметричная гантель» (рис. 2.7).
Расположение гибридных орбиталей в пространстве определяется их количеством у данного атома. В рассмотренном примере у атома бериллия две гибридные яр-орбитали расположены вдоль одной прямой (иод углом 180°), что соответствует стремлению занимающих их одноименно заряженных электронов максимально удалиться друг от друга (рис. 2.8).

Рис. 2.7. Гибридные орбитали, образованные я-, ри ?-орбиталями.
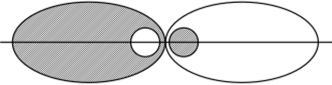
Рис. 2.8. Расположение гибридных яр-орбиталей у атома бериллия.
Три гибридные 5р2-орбитали располагаются на плоскости под углом 120° друг к другу. Четыре гибридные яр3-орбитали образуют пространственное тело — тетраэдр с углами между орбиталями 109°28'. Часто в молекулах имеются орбитали, занятые электронной парой («неподелейная электронная пара»). Такие орбитали не принимают участия в образовании химических связей, но влияют на геометрию молекулы1.