Аналитические реакции отдельных катионов

Выполнение реакции: на кусочек фильтровальной бумаги наносят каплю раствора гидрофосфата натрия, затем каплю испытуемого раствора и снова каплю Na2HP04. При этом малорастворимые фосфаты железа остаются в центре пятна, а более растворимый фосфат никеля перемещается к его периферии. Полученное пятно обводят по краю капилляром с раствором диметилглиоксима и обрабатывают бумагу парами аммиака… Читать ещё >
Аналитические реакции отдельных катионов (реферат, курсовая, диплом, контрольная)
Катион алюминия
Капельная реакция с ализарином. На фильтровальную бумагу наносят каплю раствора соли А13+ и 1—2 мин держат над открытой склянкой с концентрированным аммиаком. Получившееся водянистое пятно гидроксида алюминия смачивают каплей спиртового раствора ализарина и снова обрабатывают аммиаком. Красноватая окраска алюминиевого лака, т. е. ализарата алюминия [Al (0H)3C14H502(0H)2S03Na], становится более отчетливой после подсушивания бумаги. Последнее необходимо также для удаления избытка аммиака, который сам дает с ализарином фиолетовое окрашивание. Обнаружение А13+ в присутствии Fe3+ и других ионов, образующих лаки с ализарином, возможно лишь после осаждения их гексацианоферратом (П) калия.
Обнаруживаемый минимум — 0,65 мкг алюминия; предельное разбавление — 1 • 105 мл/г.
Катион железа (Ш)
1. Гексацианоферрат (Н) калия K4[Fe (CN)6] дает с ионом Fe3+ темно-синий осадок берлинской лазури Fe4|Fe (CN)6]3. Первоначально реакция идет по уравнению.
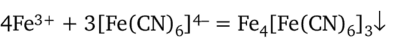
При действии большим избытком гексацианоферрата (Н) калия получается растворимая форма берлинской лазури:
![Выполнение реакции: на капельную пластинку или на полоску фильтровальной бумаги наносят каплю исследуемого раствора, каплю 2 н. раствора НС1 и каплю раствора K4[Fe(CN)6]. В присутствии железа (III) появляется синий осадок на пластинке или синее пятно на бумаге.](/img/s/8/96/1639196_2.png)
Выполнение реакции: на капельную пластинку или на полоску фильтровальной бумаги наносят каплю исследуемого раствора, каплю 2 н. раствора НС1 и каплю раствора K4[Fe (CN)6]. В присутствии железа (III) появляется синий осадок на пластинке или синее пятно на бумаге.
Обнаруживаемый минимум — 0,05 мкг; предельное разбавление —.
- 1 • 106 мл/г.
- 2. Тиоцианаты аммония NH4SCN или калия KSCN с катионом Fe3+ образуют комплекс [Fe (SCN)]2+, окрашивающий раствор в кроваво-красный цвет:
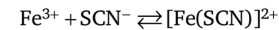
При избытке реактива равновесие этой обратимой реакции смещается вправо, и окраска раствора усиливается. Наряду с этим, как показал А. К. Бабко, образуется ряд различно окрашенных комплексных ионов:
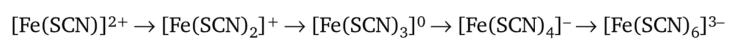
Реакцию выполняют либо в пробирке, либо капельным методом на фильтровальной бумаге. Выполнению этой чувствительной реакции мешают щавелевая, винная и фосфорная кислоты, а также фториды, образующие с Fe3+ более прочные комплексные ионы [FeF6]3-.
Обнаруживаемый минимум — 0,25 мкг; предельное разбавление —.
2 • 105 мл/г.
Выполнение реакции: на капельную пластинку или полоску фильтровальной бумаги наносят по 1 капле исследуемого раствора и разбавленного (1: 1) раствора НС1, прибавляют 2—3 капли раствора тиоцианата аммония. В присутствии ионов железа (Ш) появляется кроваво-красное окрашивание раствора или красное пятно на бумаге.
Для обнаружения следов железа (Ш) используют смесь изоамилового спирта и эфира: в пробирку помещают 1 мл исследуемого раствора, 2—3 капли разбавленного (1: 1) раствора HN03, 1 мл тиоцианата калия (или аммония) и 1 мл смеси изоамилового спирта и эфира; тщательно встряхивают смесь и дают отстояться. В присутствии железа (III) верхний слой жидкости окрашивается в красный цвет.
Катион железа (П)
Гексацианоферрат (Ш) калия K3[Fe (CN)6] дает с ионом Fe2+ темносиний осадок так называемой турнбулевой сини.
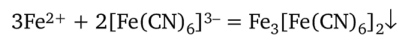
Осадок нерастворим в хлороводородной кислоте, но разлагается едкими щелочами с образованием гидроксида. Поэтому реакцию ведут в слабокислой среде.
К 2—3 каплям раствора соли железа (П) приливают 1—2 капли раствора K3[Fe (CN)6]. Реакция чаще других используется для обнаружения катиона Fe2+. Обнаруживаемый минимум — 0,1 мкг железа; предельное разбавление — 5 • 107 мл/г.
Катион марганца (Н)
Марганец в соединениях бывает двух-, трех-, четырех-, шестии семивалентным. Наиболее устойчивыми являются соединения двухи семивалентного марганца. Ион Мп2+ имеет бледно-розовую окраску, перманганат-ион (МПО4) — малиново-фиолетовую. В аналитической химии широко используется реакция окисления Мп2+ в перманганатион.
Окисление Мп2+ оксидом свинца (ГУ) происходит в присутствии азотной кислоты при нагревании:
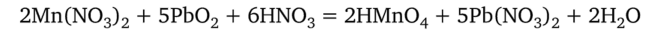
уравнения ионно-электронного баланса: 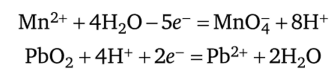 в ионно-молекулярном виде:
в ионно-молекулярном виде: 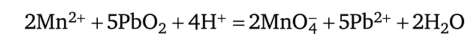
Выполнению реакции мешают избыток соли марганца (II), другие восстановители (СП, S2~, Br~, 1Д, способные восстанавливать анион МПО4 до Mn (IV) в виде осадка МпО (ОН)2 бурого цвета.
Выполнение реакции: в пробирку вносят немного РЬ02, прибавляют 1 мл концентрированной HN03 и 3—5 капель ОД н. раствора AgN03 для связывания галогенид-ионов. Смесь перемешивают, нагревают до кипения и кипятят 2 мин. Затем прибавляют 1—2 капли исследуемого раствора и снова нагревают до кипения. После охлаждения смеси прибавляют 4—5 капель дистиллированной воды и центрифугируют. В присутствии марганца жидкость над осадком окрашивается в фиолетово-розовый цвет.
Обнаруживаемый минимум — 0,1 мкг марганца; предельное разбавление — 5 • 105 мл/г.
Катион хрома (Ш)
Действие окислителей. Соли хрома (III) легко окисляются в соли хромовой (в щелочной среде) и дихромовой (в кислой среде) кислот.
1. Окисление хлорной или бромной водой происходит в две стадии: сначала диспропорционирование хлора или брома в щелочной среде:
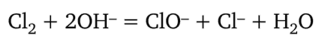
затем окисление Сг (ОН)3 в щелочной среде ионами CIO- (или ВгО-):
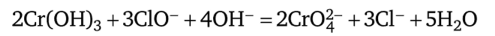
Уравнения ионно-электронного баланса:
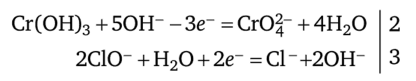
Выполнение реакции: в фарфоровую чашку помещают 2—3 капли исследуемого раствора, 3—5 капель насыщенной хлорной воды и добавляют по каплям 2 н. раствор NaOH до сильнощелочной реакции (проба на лакмус); кипятят для удаления хлора. Появление желтой окраски раствора указывает на присутствие ионов СгО^-. Обнаруживаемый минимум — 0,25 мкг; предельное разбавление — 2 • 105 мл/г.
2. Окисление персульфатом аммония в азотнокислом растворе в присутствии нитрата серебра:
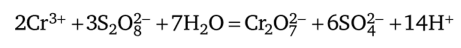
Уравнения ионно-молекулярного баланса: 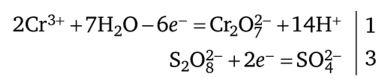
Выполнение реакции: в пробирку переносят 2—3 капли 2 н. раствора HN03, 2—3 капли ОД н. AgN03, 2—3 капли исследуемого раствора и 2—3 капли 50%-ного раствора (можно добавить несколько кристаллов) (NH4)2S208 или K2S208; смесь кипятят 2—3 мин. Появление оранжево-желтой окраски указывает на присутствие дихроматионов Сг20^_.
Обнаруживаемый минимум — 0,8 мкг; предельное разбавление — 1 • 104 мл/г.
Катион цинка
Дитизон (дифенилтиокарбазон) C13H12N4S применяют для дробного обнаружения иона цинка в присутствии других катионов третьей группы. Обычно используют 0,01%-ный раствор дитизона в хлороформе (или тетрахлориде углерода). С катионом цинка дитизон образует внутрикомплексную соль, окрашивающую в щелочной среде как слой органического растворителя, так и водный слой в малиново-красный цвет (в отличие от других катионов).
Выполнение реакции: к 3 каплям исследуемого раствора в микротигле добавляют крупинку твердого пероксида натрия и дают реакции закончиться. Затем каплю этого раствора наносят капилляром на фильтровальную бумагу так, чтобы появилась влажная зона шириной в 3—4 мм. Полученное влажное пятно обводят по периферии капилляром с раствором дитизона. Появление малиново-красного кольца указывает на присутствие катиона цинка. Обнаруживаемый минимум — 0,5 мкг цинка; предельное разбавление — 1 • 104 мл/г.
Катион кобальта (II)
Реакция М. А. Ильинского. Для обнаружения катиона кобальта Со (П) используют качественную реакцию М. А. Ильинского: реактив сс-нитрозо-(3-нафтол C]0H6(NO)OH, взаимодействуя с ионом Со2+, дает пурпурно-красный осадок Co[C10H6(NO)O]3, окисляя Со2+ до Со3+. Осадок нерастворим в минеральных кислотах. При выполнении реакции в кислой среде мешающих ионов нет.
Выполнение реакции: к 2—3 каплям анализируемого раствора в пробирке добавляют 1—2 капли 50%-ного раствора уксусной кислоты, 5 капель свежеприготовленного 0,04%-ного уксуснокислого раствора а-нитрозо-(3-нафтола и нагревают на водяной бане. Для ускорения образования осадка следует потереть палочкой о стенки пробирки.
Обнаруживаемый минимум — 0,15 мкг кобальта; предельное разбавление — 1 • 105 мл/г.
Катион никеля (II)
Диметилглиоксим (диацетилдиоксим, реактив Чугаева) C4H8N202
образует с катионами Ni2+ кристаллический ало-красный осадок внутрикомплексной соли.
К 2—3 каплям исследуемого раствора прибавляют 3—5 капель NH4OH и 2—3 капли 1%-ного спиртового раствора диметилглиоксима:
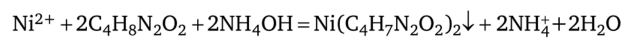
Это наиболее характерная и чувствительная реакция на ион Ni2+. Проведению ее мешает ион Fe2+, дающий с реактивом Чугаева соединение красного цвета. Однако Fe2+ можно связать в малорастворимое соединение действием гидрофосфата натрия. В присутствии Fe2+ реакцию ведут капельным методом.
Выполнение реакции: на кусочек фильтровальной бумаги наносят каплю раствора гидрофосфата натрия, затем каплю испытуемого раствора и снова каплю Na2HP04. При этом малорастворимые фосфаты железа остаются в центре пятна, а более растворимый фосфат никеля перемещается к его периферии. Полученное пятно обводят по краю капилляром с раствором диметилглиоксима и обрабатывают бумагу парами аммиака: появляется розовое кольцо или (при большом количестве Ni2+) розовое окрашивание всего пятна.
Обнаруживаемый минимум — 0,1 мкг никеля; предельное разбавление — 3 • 105 мл/г.
Катион меди (II)
Гексацианоферрат (Н) калия K4[Fe (CN)6] образует с ионом Си2+ красно-бурый осадок Cu2[Fe (CN)6]:
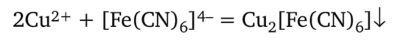
При небольшой концентрации ионов Си2+ осадок не выпадает, но раствор окрашивается в красно-бурый цвет.
Для проведения реакции к 4—5 каплям анализируемого раствора прибавляют 3—4 капли реактива. Осадок гексацианоферрата (П) меди Cu2[Fe (CN)6] нерастворим в разбавленных кислотах, но разлагается щелочами:
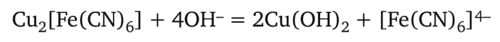
Аммиак NH4OH растворяет гексацианоферрат (П) меди Cu2[Fe (CN)6] с образованием аммиаката меди (сине-фиолетовая окраска).
Обнаруживаемый минимум — 10 мкг меди; предельное разбавление — 1 • 107 мл/г.
Катион кадмия
Сероводород H2S (или сульфид натрия Na2S) из щелочных, нейтральных и умеренно кислых растворов (pH > 5) осаждает ион Cd2+ в виде желтого сульфида кадмия, который нерастворим в щелочах и сульфиде натрия:
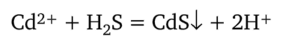
Выполнение реакции: к 5 каплям анализируемого раствора прибавляют 1—2 капли 2 н. НС1 и 0,5 см3 сероводородной воды (или пропускают сероводород). Наблюдается выделение желтого осадка сульфида кадмия CdS. Это одна из самых характерных реакций катиона Cd2+. Выполнению ее мешает избыток кислоты в растворе.
На различном отношении сульфидов кадмия и меди к кислотам основано разделение ионов Cd2+ и Си2+ в ходе анализа. Сульфид меди CuS, отличающийся малой величиной произведения растворимости (ПР = 8,5 • 10-45), осаждается сероводородом из сильнокислых растворов, а сульфид кадмия — нет.
Обнаруживаемый минимум — 5 мкг кадмия; предельное разбавление — 1 • 105 мл/г.
Катион свинца (Н)
1. Родизонат натрия C606Na2 образует с катионами РЬ2+ нерастворимый осадок родизоната свинца: фиолетовый в нейтральной среде, красный в слабокислой.
Мешающие катионы: Ag+, Hg|+, Cu2+, Ва2+, Sr2+.
Выполнение реакции: каплю исследуемого раствора помещают на фильтровальную бумагу и смачивают образовавшееся пятно свежеприготовленным 0,2%-ным водным раствором родизоната натрия. Появление фиолетового пятна (или синего при малой концентрации) указывает на присутствие свинца. Для увеличения чувствительности реакции окрашенное пятно смачивают буферным раствором, pH которого равен 2,8 (тартратный); пятно становится ярко-красным.
Обнаруживаемый минимум —0,1 мкг свинца; предельное разбавление — 5 • 105 мл/г.
Отделение от мешающих ионов. В исследуемый раствор добавляют 2 н. раствор серной кислоты для осаждения Pb2+, Ва2+, Sr2+; центрифугируют. В центрифугате возможны ионы Ag+, Hg2+, Cu2+; его переносят в другую пробирку. К осадку сульфатов приливают ацетат аммония для перевода PbS04 в раствор в виде комплексной соли (при этом сульфаты бария и стронция остаются в осадке); центрифугируют. Центрифугат анализируют на присутствие катионов РЬ (Н) реакцией с родизонатом натрия (как описано выше).
2. Бензидин (диаминодифенил) C12H8(NH2)2 окисляется соединениями свинца (1У) с образованием окрашенных в синий цвет соединений. Реакцию удобно выполнять капельным методом.
Смачивают фильтровальную бумагу аммиачным раствором 3%-ной Н202 и наносят на увлажненное место каплю исследуемого на катион РЬ2+ раствора. Бумагу держат в парах над кипящей водяной баней. Образовавшийся в результате взаимодействия соли свинца (Н) с NH4OH гидроксид свинца (II) окисляется перекисью водорода в диоксид свинца (бурый осадок):
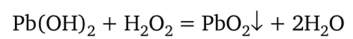
Избыток Н202 при этом разрушается. Влажное пятно на бумаге обрабатывают каплей раствора ацетата бензидина. РЬ02 окисляет бензидин, и пятно синеет. Обнаруживаемый минимум — 1,5 мкг свинца (II); предельное разбавление — 3,3 • 104 мл/г.
Катион ртути (II)
1. Алюминий, медь, цинк и железо вытесняют ртуть из растворов ее солей, так как потенциал системы Hg2+/Hg, равный +0,85 В, больше потенциала перечисленных металлов. Для обнаружения иона ртути часто применяют реакцию выделения ртути при помощи металлической меди:
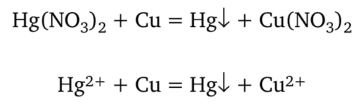
Выполнение реакции: 0,5 мл исследуемого раствора наносят на блестящую медную пластинку и оставляют на несколько минут. Пластинку высушивают и протирают образовавшееся на ней пятно фильтровальной бумагой. В присутствии ртути поверхность меди становится серебристо-белой вследствие выделения ртути (образуется амальгама меди).
Обнаруживаемый минимум — 5 мкг; предельное разбавление — 5 • 103 мл/г.
2. Дитизон (дифенилтиокарбазон) c13h12n4s в кислой среде с катионами ртути образует оранжевый осадок, растворимый в СС14.
Мешающие ионы: Sb3+, Bi3+, Cu2+, Sn2+. Для устранения мешающего влияния сурьмы и висмута добавляют винную кислоту, медь восстанавливают до одновалентной муравьиной кислотой, олово (II) окисляют до олова (ГУ) 0,5 н. раствором КМп04.
Выполнение реакции: к капле исследуемого раствора прибавляют каплю 2 н. раствора HN03, каплю 0,01%-ного раствора дитизона и встряхивают. В присутствии ртути зеленая окраска дитизона изменяется в оранжевую.
Обнаруживаемый минимум — 0,25 мкг; предельное разбавление — 2 • 105 мл/г.
Катион серебра
Хлороводородная кислота и растворимые хлориды образуют с катионом Ag+ белый творожистый осадок хлорида серебра:
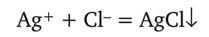
Под влиянием света хлорид серебра разлагается с выделением серебра, осадок окрашивается в фиолетовой цвет (или темно-серый).
Хлорид серебра нерастворим в кислотах, но легко растворяется в растворах аммиака, карбоната аммония, цианидов натрия или тиосульфатов с образованием комплексных ионов: [Ag (NHo)9]+, [Ag (CN)2]-, [Ag (S203)2]3Растворение в аммиаке:
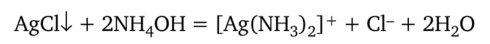
При добавлении азотной кислоты к полученному аммиачному раствору комплекс разрушается и выпадает осадок AgCl:
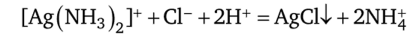
Выполнение реакции: к 1—2 каплям нитрата серебра прибавляют 1—2 капли 2 н. раствора НС1, центрифугируют. Центрифугат отбрасывают и проверяют растворимость осадка в растворе аммиака, добавив 5—7 капель 10%-ного раствора аммиака, встряхивают. К полученному раствору можно добавить 2—3 капли 2 н. раствора HN03, при этом раствор мутнеет из-за выпадения осадка AgCI.
Обнаруживаемый минимум — 1 мкг; предельное разбавление — 5 • 105 мл/г.
Контрольные вопросы и задания
1—12. Исходя из значений предельно допустимой концентрации (ПДК) катионов в природных водах и чувствительности аналитических реакций, определите возможность обнаружения ионов в воде указанными реактивами.
Ответ подтвердите расчетом минимальной концентрации. Укажите условия проведения анализа воды на присутствие указанных ионов.
№ п/п. | Катион. | ПДК, мг/л. | Реактив. |
А13+ | 0,5. | Ализарин. | |
Fe3+ | 0,3. | Тиоционат калия. | |
Fe2+ | 0,4. | Гексацианоферрат (Ш) калия. | |
Mn2+ | 0,1. | РЬ02 | |
Zn2+ | 5,0. | Дитизон. | |
C02+. | 1,0. | а-нитрозо-(3-нафтол. | |
Ni2+ | 0,1. | Диметилглиоксим. | |
Cu2+ | 1,0. | Гексацианоферрат (П) калия. | |
Cd2+ | 0,001. | Na2S. | |
Pb2+ | 0,03. | Родизонат натрия. | |
Hg2+ | 0,0005. | Дитизон. | |
Ag+ | 0,05. | НС1. |