Электролитическая ионизация.
Степень ионизации.
Константа ионизации

По степени ионизации электролиты условно подразделяются на сильные (б > 30%) и слабые (б < 3%). Степень ионизации зависит от природы растворителя. Чем более полярна молекула растворителя, тем при прочих равных условиях выше степень ионизации растворенного вещества. Поскольку электролитическая ионизация сопровождается тепловым эффектом, то степень ионизации зависит от температуры, причем влияние… Читать ещё >
Электролитическая ионизация. Степень ионизации. Константа ионизации (реферат, курсовая, диплом, контрольная)
Изучение разбавленных растворов показало, что все их общие свойства (понижение давления пара, изменение температур замерзания и кипения, величина осмотического давления) изменяются пропорционально числу частиц растворенного вещества. Эта формулировка представляет собой обобщенный закон разбавленных растворов Рауля-Вант-Гоффа. Эта общая закономерность оказалась справедливой для растворов органических веществ в воде и для растворов в органических растворителях. При исследовании водных растворов солей, кислот, оснований было обнаружено, что изменение соответствующего свойства в зависимости от состава раствора значительно превышает ожидаемую величину. Например, понижение температуры замерзания моляльного раствора NaCl превышает почти в два раза криоскопическую постоянную для воды (3,36° вместо 1,86°). Это свидетельствует о том, что число частиц в водных растворах кислот, оснований и солей не соответствует молярной концентрации раствора.
Кроме того, растворы, для которых характерны отклонения от законов разбавленных растворов, обладают значительной электропроводностью в отличие от водных растворов некоторых органических веществ. Это можно было объяснить наличием в растворе заряженных частиц. Растворы, проводящие электрический ток, были названы электролитами.
Свойства электролитов были рассмотрены и обобщены основоположником теории электролитической ионизации Аррениусом (1887) и развиты в трудах В. А. Кистяковского, И. А. Каблукова на основе химической (гидратной) теории растворения Д. И. Менделеева. Основные положения теории электролитической диссоциации:
- 1) при растворении солей, кислот и оснований в воде происходит диссоциация этих веществ с образованием электрически заряженных частиц — катионов и анионов;
- 2) электропроводность таких растворов прямо пропорциональна общей концентрации ионов в растворе.
В работах И. А. Каблукова и В. А. Кистяковского отмечалось, что электролитическая ионизация вызывается взаимодействием полярных молекул растворителя с частицами растворяемого вещества (молекулами газов, атом-ионами при растворении кристаллов). Это взаимодействие приводит к поляризации даже преимущественно ковалентных связей, как, например, в хлористом водороде. При растворении этого газа в воде происходит образование ионов водорода и хлора за счет ослабления связи Н—С1 в среде с большой диэлектрической постоянной. Переход ионов в раствор сопровождается их гидратацией:
НС1 + nН2О H+ (Н2О)x + С1- (Н2О)n-x
Такой же процесс наблюдается и при растворении ионно-ковалентных кристаллов (например, NaCI) в воде. Хотя в кристаллической решетке NaCl нет ионов Na+ и Сl-, однако взаимодействие с дипольными молекулами растворителя способствует поляризации связей в кристалле, их ослаблению и обеспечивает возможность перехода частиц в раствор с образованием гидратированных ионов:
НС1 + nН2О Na+ (Н2О)x + С1- (Н2О)n-x
Таким образом, в сильно полярных растворителях ионизируются не только вещества с преимущественно гетерополярной связью (соли), но и молекулы, характеризующиеся малой ионностью. С этой точки зрения известное правило «подобное растворяется в подобном» не является универсальным.
Процесс гидратации сильно экзотермичен и идет самопроизвольно с уменьшением энтальпии. Теплота гидратации заметно превышает энергию разрыва связи (теплоту диссоциации). Обычно степень гидратации, т. е. количество молекул растворителя, окружающих каждый ион, очень велико (n и х — целые числа, n >> 1, x >>1); лишь при ионизации кислоты х = 1:
НA + nН2О H3O+ + A-(Н2О)n-1
Это объясняется малым размером иона водорода (протона), который составляет ~10-4 от размера атома. При гидратации протон внедряется в сферу молекулы H2O с образованием оксоний-иона Н3О+. Новая ковалентная связь образуется по донорно-акцепторному механизму за счет свободной электронной пары кислорода и является насыщенной. Одной из количественных характеристик электролитической ионизации является степень ионизации, которая определяется как отношение диссоциированных молекул к общему числу растворенных молекул. Обычно степень ионизации выражают в долях единицы или в процентах:
б = (n/n0)100,.
где n0 — число растворенных частиц; n — число частиц, подвергшихся электролитической ионизации.
По степени ионизации электролиты условно подразделяются на сильные (б > 30%) и слабые (б < 3%). Степень ионизации зависит от природы растворителя. Чем более полярна молекула растворителя, тем при прочих равных условиях выше степень ионизации растворенного вещества. Поскольку электролитическая ионизация сопровождается тепловым эффектом, то степень ионизации зависит от температуры, причем влияние температуры можно оценить по принципу Ле-Шателье: если электролитическая ионизация представляет собой эндотермический процесс, то с повышением температуры степень ионизации растет, в противоположном случае — уменьшается.
Сильно влияет на степень электролитической ионизации концентрация раствора. Если рассматривать электролитическую ионизацию как равновесный обратимый химический процесс.
KA + nН2О K+ (Н2О)x + A- (Н2О)n-x ,.
то в соответствии с принципом смещения равновесия разбавление водой увеличивает количество диссоциированных молекул, т. е. степень ионизации при разбавлении возрастает. В связи с этим деление электролитов по силе в соответствии с величиной степени ионизации условно и приведенная классификация справедлива только для 0,1 н. растворов.
Процесс электролитической ионизации удобнее характеризовать константой ионизации, применив к нему законы химического равновесия. Так, для реакции КА К+ + А-
константа ионизации Ки = [К+][А-]/[КА].
Здесь и далее символом [ ] обозначаются молярные концентрации компонентов. В отличие от степени ионизации константа электролитической ионизации зависит лишь от природы электролита и температуры. Чем больше величина Ки, тем сильнее электролит.
Между константой и степенью электролитической ионизации существует количественная связь. Действительно, пусть в рассмотренном процессе общее количество растворенного вещества КА равно С, а степень ионизации равна б. Тогда [К+] = [А-] = бС и, соответственно, концентрация недиссоциированных частиц [КА] = (1 — б)С. Подставив эти значения в выражение для константы ионизации, получим:
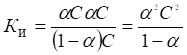
Полученное соотношение известно под названием закона разбавления Оствальда.
Для слабых электролитов, когда б << 1, Ки б2С. Отсюда.
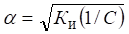
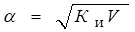
где V — разбавление, Из формулы следует, что если, например, разбавить раствор в 100 раз, то степень ионизации возрастет в 10 раз.
С учетом степени электролитической ионизации можно применить законы разбавленных растворов и к растворам электролитов введением поправочного множителя i, называемого изотоническим коэффициентом Вант-Гоффа. Тогда отношение соответствующего свойства (понижение давления пара, изменение температуры плавления и кипения, осмотическое давление) для электролита к аналогичному свойству раствора неэлектролита той же концентрации равно коэффициенту Вант-Гоффа, т. е.
?P'/?P = ?T'3/?T3 = ?T'k/?Tk = P'осм/Росм = i
Очевидно, что для растворов электролитов всегда i > 1, а для растворов неэлектролитов i = 1. Законы разбавленных растворов могут быть легко трансформированы применительно к растворам электролитов:
P'осм. = iСRT, Tзам. = iKСm,
Tкип. = iEСm, P' = iP0AxA
Изотонический коэффициент можно связать со степенью ионизации раствора электролита. Пусть степень ионизации некоторого электролита с общим числом молекул в растворе С равна б. Предположим, что при диссоциации каждая молекула электролита распадается на n ионов. Тогда число молекул электролита, распавшихся на ионы, равно бС, число ионов в растворе — nбС, а число молекул, не распавшихся на ионы, — (1 — б)С. Общее число частиц в растворе равно (1 — б)С + nбС. Отношение общего числа частиц в растворе к числу растворенных молекул представляет собой изотонический коэффициент:
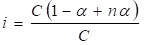
i=1 — б (1- n)
б = (i — 1)/(n — 1).
Данное соотношение позволяет определить степень ионизации электролита по отклонению его свойств от законов разбавленных растворов. В качестве примера найдем степень ионизации 0,1 н. K2SO4, который замерзает при -0,225° С (ТЗ' = 0,225°). Для водных растворов неэлектролитов криоскопическая константа равна К = 1,86°. Если бы K2SO4 не распадался на ионы в водном растворе, то соответствующее понижение 0,1 н. раствора было бы равно 0,093°. Тогда изотонический коэффициент.
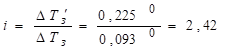
.
Поскольку каждая молекула K2SO4 распадается на 3 иона:
ионизация электролитический диссоциация.
K2SO4 > 2K+ + SO42-(n = 3),.
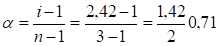
(0,71%).
т.е. K2SO4 в 0,1 н. растворе диссоциирован примерно на 71%.