Получение специфической туберкулёзной сыворотки

Для оптимизации структурных характеристик магносорбентов проведены исследования по варьированию состава компонентов синтеза (декстран, Fe2O3, алюмосиликат), а также изучение влияния времени гелеобразования и рН среды на величину удельной поверхности сорбентов, объем и размер пор. Увеличение продолжительности времени гелеобразования при синтезе МС приводит к увеличению значений удельной… Читать ещё >
Получение специфической туберкулёзной сыворотки (реферат, курсовая, диплом, контрольная)
Для получения туберкулёзных иммунных сывороток нами апробированы различные схемы иммунизации, которые отличались количеством и способом, кратностью вводимого антигена, а также адъювантами и иммуно-корректорами (полный адъювант Фрейнда, феракрил, тималин, циклофос-фан).
Общими недостатками схем иммунизации с применением адъювантов являются трудность создания стойкой эмульсии «вода в масле», длительность цикла иммунизации, травматичность для животных, связанная с возникновением у них адъювантной болезни.
Как показали результаты опытов, для получения гипериммунных туберкулёзных сывороток, наиболее приемлемой оказалась схема И. С. Тюменцевой (1994) с использованием феракрила в сочетании с комплексом антиген-антитело (Аг-Ат), который инъецировали животным на определённом этапе: грундиммунизация включала пять последовательных парентеральных введений смеси туберкулёзного антигена с 3% водно-спиртовым раствором феракрила с интервалами в 3−7 дней. Через 30 суток после последней инъекции антигена у животных брали из краевой вены уха кровь и получали не менее 4 мл иммунной сыворотки, в которую добавляли антиген с целью получения комплекса Аг-Ат. Основной цикл иммунизации состоял из четырёх внутривенных инъекций комплекса Аг-Ат через каждые 3−4 дня тому же животному, от которого была получена иммунная сыворотка. Специфические титры антител в этих сыворотках достигали в РИД — 1:32 — 1:64, что вполне удовлетворяло требованиям оценки сырья для дальнейшего получения различных диагностических препаратов.
При получении туберкулёзных агглютинирующих сывороток оптимальной оказалась схема Е. Н. Афанасьева (2000), в которой использованы вещества с иммунотропной активностью (тималин и циклофосфан). Анти-генный материал пятикратно вводили внутривенно, одновременно внутримышечно инъецировали тималин, в третью инъекцию дополнительно вводили внутримышечно циклофосфан. Агглютинирующие сыворотки, полученные таким способом, с успехом были использованы при конструировании МИБП.
Из литературных данных следует, что возбудитель туберкулёза даёт перекрёстные серологические реакции с Nocardia, Brucella, Listeria и некоторыми нетуберкулёзными микобактериями. В связи с этим, идентификация МТБ и дифференциация с нетуберкулёзными микобактериями крайне важна для практического здравоохранения и проведения подходящей антибактериальной терапии. Для этого необходимо получить специфические туберкулёзные диагностические препараты, качество которых зависит от специфичности антител. Как правило, сыворотки, полученные иммунизацией животных, недостаточно специфичны, поэтому необходима сорбция антител, дающих перекрестные реакции с гетерологичными антигенами. Для этих целей наилучшим способом является использование аффинного сорбента, который представляет собой гетерологичные антигены, закреплённые на твёрдой матрице. Очистка сыворотки происходит за счёт биоспецифического взаимодействия между антигенами, закрепленными на матрице, и антителами, подлежащими удалению.
Известны методы сорбции сывороток путём внесения в неё корпускулярных гетерологичных антигенов (Карпов С.П. с соавт, 1976; Смирнов В. В. с соавт, 1980) и использование полиакриламидного антигенного аффинного сорбента (Лопаткин О.Н., Кронгауз И. В., 1983). В первом случае сорбция корпускулярными антигенами существенно понижает специфические титры антител, зачастую приводя к полной непригодности сырья из-за появления в нём экстрагируемого из бактериальных клеток материала. Во втором же случае, при приготовлении полиакриламидных сорбентов, используются высокотоксичные импортные реактивы, а специфическая ёмкость сорбента оказывается невысокой. В связи с этим мы поставили перед собой задачу получить и испытать аффинный сорбент из экологически чистых компонентов, упростить и ускорить все этапы сорбции при максимальной очистке сыворотки от гетерологичных антител.
Проведен контроль специфичности туберкулёзных сывороток на штаммах особо опасных инфекций, нетуберкулёзных микобактерий и но-кардий. Так, например, на долю Mycobacterium intracellulare приходится около 90% микобактериозов лёгких (заболевания, сходные по клинической картине с туберкулёзом). Лечение при микобактериозах и туберкулёзе различается, что объясняется природной устойчивостью условно-патогенных мико-бактерий к основным средствам противотуберкулёзной терапии. Данные виды являются близкородственными по отношению к M.tuberculosis. Nocardia brasiliensis — патогенный представитель рода Nocardia, семейства Nocardi-aceae, порядка Actinomycetales, общего с M.tuberculosis. В литературе встре-чаются данные о наличии у него общих антигенных детерминант с МТБ. Известно серологическое сходство полисахаридов Brucella и возбудителя туберкулёза, хотя по соотношению и набору моносахаридов и физико-химическим свойствам эти полисахариды весьма различны (Домарадский И.В., 1994).
При контроле специфичности в НРИФ установлено, что наблюдаются перекрёстные реакции с Brucella abortus, M. Kansasii Yoss, Nocardia brasiliensis, M. intracellulare. Из данных культур получали бакмассы, выделяли водорастворимые антигены по описанной схеме и использовали в качестве лиган-дов при получении аффинных сорбентов.
При конструировании аффинного сорбента мы исходили из того, что необходимо выбрать матрицу, обладающую химической и микробиологической устойчивостью, жёсткостью, высокой специфической адсорбционной способностью, найти способ щадящего и вместе с тем надёжного (ковалентного) закрепления на ней соответствующих лигандов.
Для этих целей нами применен аффинный сорбент с магнитными свойствами, где в качестве твердой фазы выступает кремнезем-алюмосиликат, который является мелкодисперсным наполнителем, представляющим собой комплексные анионы алюминия и кремния с избыточным отрицательным зарядом, компенсированным щелочноземельными металлами. Носитель обладает повышенными адгезионными свойствами по сравнению с полиакрила-мидом и силохромами. Кроме того, алюминирование кремнезёма существенно увеличивает адсорбционную активность в отношении белков (Хохлова Т.Д., Гаркавенко Л. Г., Никитин Ю. С., 1991).
Процесс получения сорбента заключался в следующем: к 1 г алюмоси-ликатного наполнителя добавляли 40 мл 3% водного раствора полиглю-кина и магнитный порошок (Fe2O3) от 1 до 5 г, перемешивали и проводили гелеобразование при температуре (22±4) оС от 1 до 24 ч. Полученный сорбент высушивали при 100−110 0С в течение 30 мин, измельчали и методом рассева выделяли фракции с размером частиц 80- 120 мкм.
Процесс получения сорбента состоял из следующих стадий: образование золя, переход его в гидрогель и обезвоживание, приводящее к получению ксерогеля. В золе мицеллы вещества свободно двигаются по законам броуновского движения. Сольватные оболочки мицелл, а так же поверхностный заряд препятствуют их слиянию, образованию прочных связей при столкновении и обеспечивают устойчивость золя. При повышении температуры происходит потеря гидратной оболочки мицелл, они связываются между собой силами сцепления в жёсткий каркас. Частицы укрупняются, контакты срастаются, что приводит к упрочнению скелета геля и уменьшению дисперсности частиц, в результате чего образуется ксерогель.
Удельную поверхность МС определяли по методу А.А.Клячко-Гурвича (1961), а суммарный объем и радиус пор — по методу Н. В. Кельцева (1984).
Для оптимизации структурных характеристик магносорбентов проведены исследования по варьированию состава компонентов синтеза (декстран, Fe2O3, алюмосиликат), а также изучение влияния времени гелеобразования и рН среды на величину удельной поверхности сорбентов, объем и размер пор. Увеличение продолжительности времени гелеобразования при синтезе МС приводит к увеличению значений удельной поверхности и уменьшению размера пор. Стабилизирующий эффект действия декстрана объясняется образованием вокруг частиц геля сольватных оболочек в связи с возникновением комплексов между электронодонорными атомами кислорода молекул органического вещества и силанольными группами кремнеземных корпускул.
На наш взгляд, оптимальным значением времени гелеобразования при синтезе сорбентов является 1−2 часа, так как при увеличении времени синтеза магносорбента уменьшается радиус его пор, что приводит к снижению степени иммобилизации лиганда при ковалентном связывании в порах сорбента, стерическим препятствиям образования специфического комплекса антиген-антитело.
На основе проведенных исследований рекомендованы следующие оптимальные условия получения алюмосиликатных МС: соотношение компонентов синтеза Fe2O3, декстран, алюмосиликат 2:2:1, время гелеобразования 2 — час при рН — 7,0.
На рисунке 3 представлена фотография микроструктуры алюмосили-катного магносорбента, из которой следует, что у образца магносорбента наблюдается ярко выраженная губчатая структура.
Исследование удельной поверхности по методу А.А.Клячко-Гурвича (1961) показало, что введение магнитного порошка (Fe2O3) в структуру кремнеземного сорбента изменяет его структурные характеристики: удельная поверхность в данном случае достигает 18 м /г, объем пор 1,19 см /г, радиус пор 132,2 нм, тогда как сорбент, не содержащий в своём составе Fe2O3, имеет удельную поверхность — 58 м /г, объем пор- 1,70 см /г, радиус пор — 42,5 нм.
Концентрация альдегидных групп активированных сорбентов состави-ла 0,57 мг-экв/г. Достоверность и воспроизводимость аналитического метода определения альдегидных групп представлена в таблице 3.
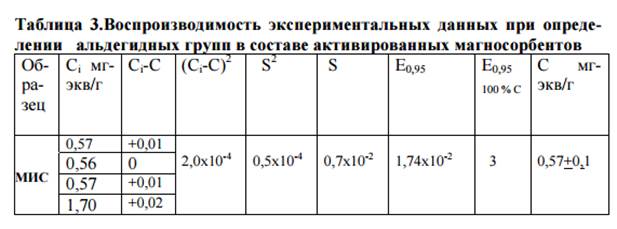
Далее проводили иммобилизацию гетерологичных водорастворимых антигенов (Brucella abortus 19, Nocardia brasiliensis, M. intracellulare, M. Kansasii Yoss) на сорбенты, для чего исследовали ряд параметров: концентрацию белка в антигенах, время и температуру инкубации, влияние рН на иммобилизацию лигандов.
Иммобилизацию лигандов на поверхности магносорбента проводили следующим образом: к 0,4 мл 10% взвеси МС приливали 1 мл водорастворимых антигенов, варьируя количеством белка от 0,5 до 10 мг/мл, инкубацию проводили в течение 1−24 часов, при температуре 4−5 °С; (22 + 4) °С и (37±1) °С. Далее надосадочную жидкость удаляли, а носитель промывали °, 9% раствором хлорида натрия до полного удаления белка, наличие которого в промывной жидкости контролировали спектрофотометрически.
Для иммобилизации использовали различную концентрацию белка водорастворимых антигенов (°, 5−1° мг/мл). Исследования показали, что концентрация белка 2,5 мг/мл является оптимальной для полного насыщения антигенами сорбента, находящегося в 1° % взвеси. При использовании лиганда с концентрацией белка больше 2,5 мг/мл адсорбционная емкость МИС снижалась. Вероятно, зависимость адсорбционной емкости сорбента от количества иммобилизуемого белка объясняется факторами стерического характера (Муромец В.И., Наградова Н. К, 1984).
Изучена кинетика процесса иммобилизации и оценка связывания вы-деленных антигенов с сорбентом. Из полученных данных следует (рис. 5), что 2 ч достаточно, чтобы произошло полное насыщение МС антигенами.
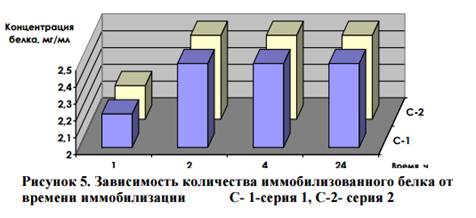
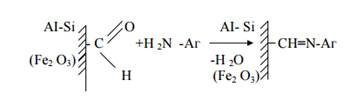
Схема получения иммобилизованных антигенов на МС представлена на рис. 6.
Ковалентное связывание водорастворимых антигенов с твердой матрицей осуществляется через альдегидную группу с образованием азометиновой связи.
При определении зависимости рН раствора водорастворимых антиге-нов на процесс иммобилизации установлено, что изменение рН от 5 до 9,5 не сказывается на специфической активности и чувствительности МИС.
Определена максимальная адсорбционная емкость сорбента, которая наблюдалась при температуре (22 + 4) °С и (37±1) °С.
Таким образом, оптимальными факторами, способствующими получе-нию МИС, являются: время иммобилизации лигандов на сорбенте — 2 часа при значении рН раствора водорастворимых антигенов 6−7 и температуры в интервале 24 — 37 оС.
Методы получения иммуносорбентов просты и технологичны, исклю-чающие применение токсичных веществ. Полученные магноиммуносорбен-ты характеризуются стандартностью структурных характеристик, механической, химической и микробиологической устойчивостью, не подвержены набуханию, равновесие между антигенами и сорбентом наступает в течение 2 часов. Использование отечественных экологически чистых компонентов, их дешевизна, простота технологии изготовления свидетельствуют о достоинствах алюмосиликатных МИС.
Иммуносорбцию проводили дважды, соединяя 1° мл иммунной туберкулёзной сыворотки с 1 г магноиммуносорбента. Смесь инкубировали при 37 °C в течение 6 часов или при температуре 4 °C — 16 часов на шуттель — аппарате. После инкубации, используя постоянный магнит (при этом отпадает необходимость центрифугирования или фильтрования) для фиксации МИС, сыворотку сливали. Сорбент регенерировали 3 М раствором калия роданистого и отмывали 0,1 М фосфатно-солевым буфером рН (7,3 ± 0,1). Такой сорбент после процедур регенерации можно использовать до 10 — 15 раз. Магнитные свойства иммуносорбента позволили осуществлять отделение его от жидкой фазы в магнитном поле и исключить процесс длительного центрифугирования.
Титр антител и специфичность туберкулёзных сывороток, определяе-мые в НРИФ в мазках гомологичных и гетерологичных штаммов микроорганизмов, окрашенных иммуноглобулинами флуоресцирующими антикроличьими, представлен в таблице 4.
Из таблицы видно, что до сорбции туберкулёзной сыворотки наблюдалась перекрестная реакция со штаммами B. abortus, М. intracellulare, Nocar-dia brasiliensis, M. Kansasii Yoss при её активности 1:400 в реакции НРИФ. При сорбции иммунной сыворотки использование данного иммунносорбента позволило не только освободить препарат от неспецифических антител на одном этапе, но и сохранить первоначальную специфическую активность нативных сывороток.
Проведённые исследования дают основание утверждать, что применение алюмосиликатных антигенных магноиммуносорбентов позволяет проводить качественную иммуносорбцию. Преимуществами её являлось то, что при сорбции не происходило попадания в сыворотку антигенного материала и в ней отсутствовал комплекс «антиген-антитело», мешающий в дальнейшем созданию специфических диагностических систем.
Такая иммуносорбция приводила к повышению специфичности сывороток. Титры специфических антител не снижались и конечный продукт оставался качественным сырьем для дальнейшей работы.
Таким образом, нами разработана биотехнология получения аффинного сорбента с магнитными свойствами. В качестве матрицы использовали алюмосиликат — химически чистый сорбент, имеющий жёсткий остов, обладающий значительной адсорбционной ёмкостью, микробиологической и химической устойчивостью, механической прочностью. Для придания сорбентам биоспецифических свойств в структуру или на их поверхность иммобилизовали антигены путём ковалентной сшивки, т. е. образования химической связи при участии неспаренных электронов, принадлежащим обоим партнёрам по реакции (наиболее прочная связь). Для её осуществления нами использован перхлорат натрия. В результате варьирования соотношением компонентов синтеза, отработки всех параметров: рН, температуры, времени, способов иммобилизации лигандов получены магноиммуносорбенты, пористая структура которых наиболее эффективна для образования иммуно-химического комплекса «антигенантитело». Наличие магнитного материала обеспечивает упрощение, ускорение манипуляций с сорбентами. Данные сорбенты отличаются простотой технологии изготовления, экологической чистотой, доступностью сырья и низкой стоимостью.