Электролитическая диссоциация.
Общая химия

В 1884 г. шведский физико-химик С. Аррениус объяснил электрическую проводимость солей их распадом на положительно и отрицательно заряженные ионы. Развивая эту идею дальше, он опубликовал в 1887 г. теорию электролитической диссоциации. На основе электролитической диссоциации Аррениус объяснил также общие свойства кислот и оснований. Довольно быстро его теория получила всеобщее признание… Читать ещё >
Электролитическая диссоциация. Общая химия (реферат, курсовая, диплом, контрольная)
Изучив содержание главы 13, студенты должны: знать
- • сущность и причины электролитической диссоциации;
- • понятия о сильных и слабых электролитах;
- • особенности физико-химических свойств растворов электролитов;
- • характеристики свойств раствора электролита; уметь
- • рассчитывать степень диссоциации слабого электролита;
- • рассчитывать активность ионов в растворах сильных электролитов;
- • рассчитывать осмотическое давление и температуры замерзания и кипения растворов электролитов;
- • составлять уравнения химических реакций в растворах электролитов в ионной форме;
владеть
• навыками определения природы раствора (электролит, неэлектролит).
Растворы электролитов
В 80-х гг. XIX в. мснсс чем за 10 лет были разработаны важнейшие разделы теории растворов, включая и теорию электролитической диссоциации.
Водные растворы разнообразных веществ сильно различаются по способности проводить электрический ток. Вода имеет крайне малую удельную электрическую проводимость и соответственно большое удельное сопротивление (-106 Ом м). Есть вещества, при растворении которых электрическая проводимость получаемого раствора практически не возрастает. Примерами таких веществ являются углеводы (сахароза, глюкоза и др.), карбамид, спирты. Их называют неэлектролитами. Неорганические и органические вещества, относящиеся к классам кислот, оснований и солей, образуют растворы с большой электрической проводимостью.
Вещества, проводящие в растворах и расплавах электрический ток, называются электролитами.
В 1884 г. шведский физико-химик С. Аррениус объяснил электрическую проводимость солей их распадом на положительно и отрицательно заряженные ионы. Развивая эту идею дальше, он опубликовал в 1887 г. теорию электролитической диссоциации. На основе электролитической диссоциации Аррениус объяснил также общие свойства кислот и оснований. Довольно быстро его теория получила всеобщее признание и оказалась настолько простой и убедительной, что до настоящего времени преподается в школах.
Само по себе наличие электрической проводимости раствора не обязательно означает, что растворенное вещество распалось на ионы. Могут быть разные механизмы проводимости. Но есть другие факты, доказывающие распад веществ на ионы и присутствие ионов в растворах.
При измерении осмотического давления растворов разных веществ, давления пара растворителя над раствором, понижения температуры замерзания и повышения температуры кипения растворов оказалось, что растворы электролитов сильно отклоняются по этим свойствам от законов Вант-Гоффа и Рауля, выражаемых формулами (12.6)—(12.9). У разбавленных растворов солей эти отклонения приблизительно в целое число раз (2, 3, 4) превышают предсказания теории. Например, измеренное осмотическое давление раствора хлорида калия при концентрации 0,01 моль/л и 0 °C равно 44,1 кПа. При этом осмотическое давление, рассчитанное для тех же условий по закону Вант-Гоффа, составляет 22,7 кПа. При первом же взгляде на цифры очевидно, что измеренное значение почти в 2 раза превышает ожидаемое. Простое объяснение этого факта состоит в том, что раствор на самом деле содержит частиц в 2 раза больше, чем было бы предполагаемых молекул КС1. Соль в растворе находится не в виде молекул, а в виде свободно движущихся ионов К+ и С1″, число которых в 2 раза превышает число структурных единиц КС1. В этом и состоит причина отклонений от закона Вант-Гоффа, а также и закона Рауля.
Отношение экспериментально найденных значений для свойств раствора к рассчитанным по законам Вант-Гоффа и Рауля называется изотоническим коэффициентом, или коэффициентом Вант-Гоффа
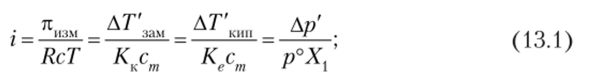
в приведенных здесь отношениях штрихом отмечены измеренные значения свойств; в знаменателях поставлены формулы, по которым вычисляются теоретические значения тех же свойств для растворов неэлектролитов.
Если изотонический коэффициент данного раствора известен, то осмотическое давление и другие свойства могут быть вычислены. Например, согласно отношениям (13.1) реальное осмотическое давление электролита.

Значения изотонического коэффициента для разных электролитов приводятся в таблицах (табл. 13.1).
Физический смысл изотонического коэффициента состоит в том, что он показывает, во сколько раз действительное число осмотически активных (свободно перемещающихся в растворе) частиц в единице объема раствора превышает предполагаемое число молекул. Например, если концентрация хлорида калия составляет 0,2 моль/л, то суммарная концентрация реально имеющихся ионов близка к 0,4 моль/л.
Таблица 13.1
Значения изотонического коэффициента для растворов некоторых солей при концентрации 0,1 моль/л
Формула. | Понижение температуры замерзания. | i | |
Дгзам, экспериментальное. | Д?зам, вычисленное по закону Рауля. | ||
КС1. | 0,673. | 0,372. | 1,81. |
KN03 | 0,664. | 0,372. | 1,78. |
MgCl2 | 1,038. | 0,372. | 2,79. |
Ca (N03)2 | 0,923. | 0,372. | 2,48. |
Пример 13.1. Какие предельные значения изотонического коэффициента можно ожидать для растворов бромида натрия, хлорида кальция и сульфата алюминия?
Решение. Напишем формулы веществ: NaBr, CaCl2, Al2(S04)3. Эти соли распадаются на два, три и пять ионов соответственно. К этим числам приближаются их изотонические коэффициенты при сильном разбавлении растворов.
Таким образом, одновременно проявляющиеся в растворе способность проводить электрический ток и сильные отклонения от законов ВантГоффа и Рауля подтверждают реальность явления электролитической диссоциации.
В растворах электролитов переносчиками электрического тока являются ионы, свободно перемещающиеся в среде и приобретающие направленное движение в электрическом поле. Такие проводники называют проводниками второго рода. Ионы могут быть как одноатомными, так и многоатомными частицами. Заряд иона создается избытком или недостатком электронов относительно суммарного заряда атомных ядер. Положительно заряженный ион называется катион, отрицательно заряженный — анион.
Одноатомные катионы производятся от атомов металлов, лишенных одного или нескольких электронов: Na+, Mg2+, Fe3+ и др. Многоатомные катионы представляют собой продукт присоединения протона Н+ к молекуле (Н30+, NH4, CH3NH3) или катионные комплексы. Большинство часто встречающихся анионов — это кислотные остатки. Анионы бинарных кислот и солей — одноатомные частицы. Анионы кислородсодержащих, органических и комплексных кислот и солей представляют собой многоатомные частицы.
Наиболее многочисленные электролиты — это соли. Всякая соль может считаться веществом, состоящим из катионов и анионов. Соли имеют ионные кристаллические структуры, т. е. действительно состоят из заряженных частиц, связанных силами электростатического притяжения. При растворении в воде ионы переходят из связанного состояния в кристалле к свободному (в смысле возможности перемещения) в растворе. Поэтому кристаллы солей, как правило, электричество не проводят, а растворы проводят.
Аналогичным образом построены и гидроксиды металлов, но только в их составе имеется особый анион гидроксид ОН-, продукт отнятия протона от молекулы воды. Основания — это вторая разновидность электролитов.
Третья разновидность электролитов — вещества класса кислот. В отличие от солей и гидроксидов металлов они имеют молекулярное строение, и было бы неправильно сказать, что кислота состоит из катионов водорода и анионов кислотного остатка. Свойства кислот как электролитов объясняются способностью частицы Н+, иначе говоря, протона /?+, к переносу от молекулы кислоты к молекуле воды, в результате чего образуются ионы и возникает электрическая проводимость:

Можно сказать, что в этом и заключается секрет поведения кислот: в отличие от других водородных соединений, в кислотах имеется подвижный атом водорода, ядро которого — р+ — переносится от молекулы кислоты к молекуле воды.