Направление окислительно-восстановительных реакций

Иногда приходится иметь дело и с такими окислительно-восстановительными реакциями, когда значения Е° для окислителя и восстановителя близки между собой. В таких случаях для решения вопроса о направлении реакции необходимо учитывать влияние концентраций окисленной и восстановленной форм соответствующих веществ на электродные потенциалы. Уравнение, связывающее величину электродного потенциала… Читать ещё >
Направление окислительно-восстановительных реакций (реферат, курсовая, диплом, контрольная)
При описании окислительно-восстановительных реакций нельзя ограничиваться лишь качественной стороной протекания процесса, а необходимо уметь и количественно характеризовать его, что позволяет определять направление данной реакции. Для количественной оценки окислительновосстановительных реакций важное значение имеют такие характеристики, как окислительно-восстановительные потенциалы и определение изменения энергии Гиббса системы.
Окислительно-восстановительные потенциалы. Рассмотрим реакцию взаимодействия цинка с раствором сульфата меди:
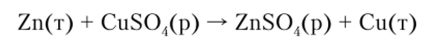
При постоянных температуре и давлении (25°С и 101 325 Па) в соответствии с законом Гесса процесс будет сопровождаться тепловым эффектом:
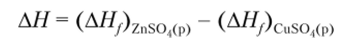
Цинк как восстановитель отдает электроны. Этот процесс можно изобразить в виде полуреакции 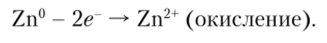
Ион меди как окислитель принимает электроны, что выражается второй полуреакцией.
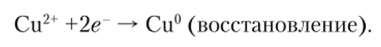
Обе полуреакции протекают в месте соприкосновения цинка с раствором CuS04, и при этом электроны переходят непосредственно от цинка к ионам меди. Данную реакцию можно осуществить и так, чтобы окислительная и восстановительная полуреакции были пространственно разделены. Тогда электроны будут переходить от восстановителя к окислителю по проводнику электрического тока — внешней цепи. Для этого цинковую пластинку погружают в раствор ZnS04, а медную — в раствор CuS04. Если оба полученных полуэлемента соединить трубкой, заполненной токопроводящим раствором, то получится гальванический элемент Даниэля — Якоби (рис. 9.2).
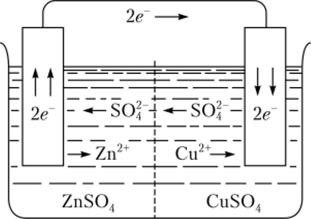
Рис. 9.2. Схема движения ионов и электронов при работе медно-цинкового
гальванического элемента
В первом полуэлементе на цинковом электроде (анод) происходит окисление цинка, а во втором полуэлементе на медном электроде (катод) — восстановление меди. Электроны движутся от цинкового электрода по внешней цени к медному вследствие возникшей разности потенциалов. При суммировании уравнений обеих полуреакций получим уравнение токообразующей реакции:
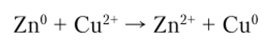
Образующиеся в процессе окисления катионы цинка создают в растворе избыточный положительный заряд. Раствор, в котором находится медный электрод, обедняется катионами меди, поэтому этот раствор характеризуется избыточным отрицательным зарядом. В возникшем электрическом поле катионы меди и цинка перемещаются от цинкового электрода к медному, а анионы S04+ — от медного к цинковому электроду, что можно представить схемой.
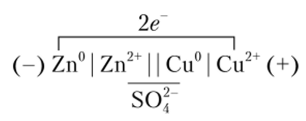
Электродвижущая сила (ЭДС) гальванического элемента возникает за счет протекания окислителыю-восстаиовителыюй реакции. Движущей силой химической реакции является убыль энергии Гиббса AG, которая определяет максимальную работу химической реакции. При замыкании внешней цепи часть энергии системы расходуется на выделение джоулевой теплоты, нс сопровождающееся полезной работой, и процесс протекает необратимо. Максимальную же работу гальванический элемент совершает при обратимом проведении реакции в равновесных условиях. Это возможно тогда, когда ЭДС элемента полностью скомпенсирована внешней ЭДС (равной по величине и противоположной по знаку). При этом изменение свободной энергии определяется произведением протекающего через гальванический элемент электричества на напряжение элемента Е:

где п — число молей, передаваемых в процессе электронов; F — постоянная Фарадея (величина nF равна количеству электричества).
Если процесс протекает в стандартных условиях (25°С, активность ионов равна 1), то напряжение элемента обозначается Е°, а соответствующее изменение энергии — AG°. Уравнение (9.1) примет вид.

Отрицательный знак правой части уравнения (9.2) показывает, что если электрохимический элемент самопроизвольно создает электрическое напряжение, то в результате система должна терять энергию. Величина Е°, называемая стандартным электродным (окислительно-восстановительным) потенциалом, представляет собой потенциал данного электродного процесса, в котором активность всех участвующих в нем ионов равна 1.
Чтобы определить Е°, необходимо иметь другую электродную систему с известным потенциалом. Объединяя две электродные системы в гальваническую ячейку, можно измерить ее ЭДС. В качестве стандартного электрода принята водородная система, состоящая из платиновой черни, насыщенной газообразным водородом. Значения стандартного электродного потенциала растворенных веществ относят к 1 М растворам, а для газообразных соединений — к 101 325 Па. Так как Е° для водородного электрода принят равным нулю, то АС° реакции.
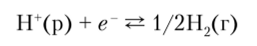
должно быть также условно принято равным нулю. Следовательно, если М" + (окисленная форма системы Ми+/М (т)) является лучшим окислителем (акцептором электронов), чем Н30 то реакция.
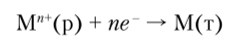
сопровождается уменьшением свободной энергии. Стандартный электродный потенциал такой реакции имеет положительное значение (уравнение (9.1)). С другой стороны, если М является лучшим восстановителем, чем водород, то стандартный электродный потенциал такой реакции будет отрицательным. Так, для системы.
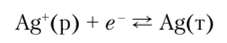
равновесие смещено в сторону образования металла, поэтому AG° < 0 и Е° > 0; истинное значение Е° = +0,80 В.
Например, у натрия равновесие «металл — ион металла» смещено в сторону иона и Е° = -2,71 В.
Из этих примеров легко понять, что реакции с участием сильноосновных элементов (Li, К, Na, Са и т. д.), которые легко отдают электроны (восстановители), характеризуются отрицательным значением Е°, в то время как реакциям с участием слабоосновных элементов, имеющих тенденцию к присоединению электронов (окислители), отвечают положительные значения Е°. Ряд элементов, расположенных в порядке возрастания стандартных электродных потенциалов, называют электрохимическим рядом (табл. 9.1).
В процессах образования катионов в растворе элемент, стоящий выше в этом ряду, будет вытеснять элементы, стоящие ниже.
Из табл. 9.1 ясно, что хлор (Е° = +1,36) — более сильный окислитель, чем бром (Е° = +1,07), а цинк (Е° = -0,76) — более сильный восстановитель, чем свинец (Е° = -0,13).
Таблица 9.1
Электрохимический ряд.
Реакция. | Е В. | Реакция. | Е В. |
 | — 3,04. |  | — 0,14. |
 | — 2,92. |  | — 0,13. |
 | — 2,90. |  | 0,00. |
 | — 2,87. |  | +0,37. |
 | — 2,71. |  | +0,54. |
 | — 2,37. |  | +0,77. |
 | — 1,66. |  | +0,79. |
 | — 1,18. |  | +0,80. |
 | — 0,76. |  | +0,85. |
 | — 0,74. |  | + 1,07. |
 | — 0,44. |  | + 1,36. |
 | — 0,28. |  | +2,80. |
 | — 0,25. |
Если требуется сравнить две окислительно-восстановительные системы и выяснить, в каком направлении может протекать реакция, то необходимо сопоставить их нормальные потенциалы. Система, характеризующаяся более положительным потенциалом, будет играть роль окислителя, т. е. проявлять тенденцию к присоединению электронов. Так, если смешать растворы солей (Sn4+, Sn2') и (Fe3+, Fe2+), то реакция.
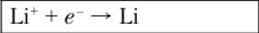
пойдет слева направо, так как Ере > Е$п.
Многие окислители являются анионами кислородсодержащих кислот, и их реакции обычно протекают в кислой среде: 
В табл. 9.2 приведены значения восстановительных потенциалов окислительно-восстановительных систем в водных растворах.
Таблица 9.2
Стандартные потенциалы некоторых окислительно-восстановительных систем
в водных растворах при 25°С
Реакция. | Е°, В. |
 | — 1,22. |
 | — 0,932. |
 | — 0,832. |
 | — 0,58. |
 | — 0,132. |
 | 0,00. |
 | +0,01. |
 | +0,33. |
 | +0,36. |
 | +0,36. |
 | +0,54. |
 | +0,59. |
 | +0,61. |
 | +0,66. |
 | +0,68. |
 | +0,96. |
 | + 1,00. |
 | + 1,19. |
 | + 1,23. |
 | + 1,33. |
 | +1,512. |
 | + 1,52. |
 | + 1,70. |
 | + 1,78. |
Часто вместо символа Е° используют символ ср°.
Пользуясь данными табл. 9.1 и 9.2, можно определить, в какую сторону будут протекать реакции с участием FeCl3 и галогенидами, что представлено в общем виде:
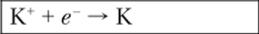
Для пяти возможных электродных реакций находим значения стандартных электродных потенциалов: 
Представим предполагаемую реакцию в ионной форме:

Известно, что самостоятельный переход электронов происходит от электрохимической системы с более низким значением электродного потенциала к системе с более высоким его значением. Из этого следует, что первая из этих систем будет восстановителем, а вторая — окислителем. Разность между значениями Е° в реакции FeCl3 с галогенидами будет соответственно равна: для KF Е° = 0,77 — 2,80 = -2,03 В; для КС1 Е° = 0,77 — 1,36 = -0,59 В; для КВг Е° = 0,77 — 1,07 = -0,30 В; для KI Е° = 0,77 — 0,54 = +0,23 В. Как видим, разность между стандартными потенциалами имеет положительное значение только в случае KI, поэтому именно в присутствии иодида калия реакция протекает слева направо, т. е. будет происходить восстановление Fe3' до Fe2+.
Рассмотрим возможность окисления ЫВг водными растворами КМп04 или К2Сг207.
Для систем 
значения Е° соответственно равны +1,51 В и +1,33 В.
Для реакции Вг2 + 2е~ —" 2Вг; Е° = +1,07 В.
Следовательно, оба раствора будут окислять НВг.
Иногда приходится иметь дело и с такими окислительно-восстановительными реакциями, когда значения Е° для окислителя и восстановителя близки между собой. В таких случаях для решения вопроса о направлении реакции необходимо учитывать влияние концентраций окисленной и восстановленной форм соответствующих веществ на электродные потенциалы. Уравнение, связывающее величину электродного потенциала с концентрациями окисленной и восстановленной форм вещества и температурой, имеет вид.

где R — молярная газовая постоянная; п — число передаваемых в процессе молей электронов; Т — абсолютная температура; F — постоянная Фарадея; [ок| — концентрация окисленной формы; [вое| — концентрация восстановленной формы; тц — коэффициенты в уравнении реакции. Используя соотношение (9.3), называемое уравнением Нернста, рассмотрим реакцию.

которая самопроизвольно может идти в обоих направлениях в зависимости от концентраций ионов железа и ртути. При этом имеют место две электрохимические системы: 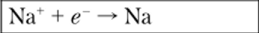
Каждому электродному процессу в соответствии с формулой (9.3) отвечают следующие потенциалы: 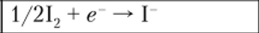
Допустим, что [FIg2+] = [Fe2+] = 10 1 моль/1000 г Н20, a [Fe3t] = 10 4 моль/ 1000 г Н20. Подставляя эти данные в соотношения для ?, и Ev получим.

Эти данные показывают, что Е{ > Е2. Следовательно, реакция протекает слева направо.
Если представить обратное соотношение концентраций, т. е. |Hg2+] = = |Fe2+] = 10'4, a [Fe3+] = 10″ 1 моль/1000 г Н20, то.
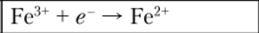
Имеем ?, < Ev поэтому реакция протекает справа налево.
Направление и полноту протекания окислительно-восстановительной реакции можно определить исходя из константы равновесия. Так, для процесса, выражаемого следующими двумя полуреакциями:

где mw q — стехиометрические множители окислительно-восстановительной реакции, произведение mwq равно количеству электронов, передаваемых в ходе реакции.
Поскольку в момент равновесия наступает равенство потенциалов окислителя и восстановителя, то, пользуясь уравнением (9.3), можно рассчитать К?. Обозначим Еок = Ev а Евос = ?.;, т. е. Ех = Е.;, тогда в соответствии с уравнением Нернста имеем.

Подставив значения R> Т и F, например, при 25 °C, получим 
или.
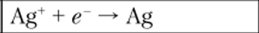
откуда следует, что.

Так как  , то.
, то.

Следовательно,.

где п — число электронов, передаваемых в процессе. Например, для реакции.

Если К? > 1, то реакция протекает в направлении образования ее продуктов, т. е. слева направо. Когда К?< 1, то реакция смещена в сторону исходных веществ.