Термохимическое обезвреживание газовых выбросов

Термоокислительные методы менее специфичны, чем термовосстановительные, однако и они не универсальны. Возможности термоокислительного метода обезвреживания ограничиваются также количеством отбросных газов и содержанием в них горючих компонентов. Если концентрация горючих компонентов выбросов не достигает нижнего предела воспламенения («бедные» горючим выбросы), то их огневая обработка требует… Читать ещё >
Термохимическое обезвреживание газовых выбросов (реферат, курсовая, диплом, контрольная)
Помимо механических, физико-химических и химических методов очистки газов широко применяют термические методы. Методы сжигания и дожигания вредных примесей, способных окисляться, находят все большее применение для очистки дренажных и вентиляционных выбросов. Эти методы выгодно отличаются от других (например, мокрой очистки в скрубберах) более высокой степенью очистки, отсутствием в большинстве случаев коррозионных сред и исключением сточных вод.
Химические реакции между ингредиентами газовых выбросов, которые в обычных условиях практически незаметны, значительно ускоряются с повышением температуры. Система, содержащая токсичные вещества, может быть обезврежена термообработкой, если реакции, происходящие в ней, приведут к образованию менее токсичных компонентов.
По типу происходящих реакций методы термообезвреживания можно разделить на термовосстановительные и термоокислительные.
Термовосстановительные методы специфичны и разрабатываются индивидуально для каждого конкретного загрязнителя. Из них к настоящему времени в технике газоочистки нашли применение способы термохимического (с использованием аммиака) и термокаталитического восстановления NOx до ?2, термокаталитического восстановления SO2 до S2, некоторые другие.
Из всех термоокислительных процессов для термообезвреживания пригодны исключительно реакции с кислородом, поскольку при участии иных окислителей принципиально невозможно получить безвредные продукты окисления. Поэтому далее под термином «окисление» подразумевается процесс, окислителем в котором служит кислород.
Термоокисление газообразных загрязнителей может происходить в газовой фазе (в объеме) или на границе раздела фаз (на поверхности).
Газофазный процесс осуществляют непосредственной огневой обработкой (сжиганием в пламени) газовых выбросов при температурах, превышающих температуру воспламенения горючих компонентов выбросов.
Для организации процесса окисления на границе раздела фаз используют катализаторы — конденсированные вещества, способные за счет активности поверхностных частиц ускорять процесс окисления того или иного загрязнителя при температурах ниже температуры воспламенения.
Термоокислительные методы менее специфичны, чем термовосстановительные, однако и они не универсальны. Возможности термоокислительного метода обезвреживания ограничиваются также количеством отбросных газов и содержанием в них горючих компонентов. Если концентрация горючих компонентов выбросов не достигает нижнего предела воспламенения («бедные» горючим выбросы), то их огневая обработка требует дополнительного расхода топлива на прогрев выбросов до температуры самовоспламенения, которая для паров углеводородов составляет около 500…750°С. Температурный уровень процесса термокаталитического окисления несколько ниже (обычно 350…500°С), что также требует соответствующих затрат топлива.
Степень нейтрализации обезвреженных газовых выбросов.
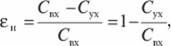 (7.80).
(7.80).
где Свх и Сух — суммарная токсичность подлежащих нейтрализации и нейтрализированных газовых выбросов.
Каталитическая очистка газовых выбросов
Каталитический метод очистки основан на взаимодействии обезвреживаемых веществе вводимым в очищаемую газовую среду окисляющим веществом в присутствии катализатора. В результате реакций находящиеся в газе примеси превращаются в другие соединения, представляющие меньшую опасность, или легко отделяются от газа.
Каталитические нейтрализаторы применяют для обезвреживания оксида углерода, летучих углеводородов, растворителей, отработавших газов в химических установках и выхлопов автомобильного транспорта.
Каталитическое дожигание как метод термической нейтрализации газовых выбросов используют для превращения токсичных компонентов, содержащихся в отходящих газах, в нетоксичные или менее токсичные путем их контакта с катализаторами. Каталитическая очистка позволяет обезвреживать оксиды азота, оксид углерода, другие вредные газовые загрязнения. Каталитическая очистка применяется в основном при небольшой концентрации удаляемого компонента в очищаемом газе, когда невыгодно использовать для их обезвреживания метод прямого сжигания. В этом случае процесс протекает при температуре 200…300°С, что значительно меньше температуры, требуемой для полного обезвреживания при прямом сжигании в печах и равной 950…1100°С. Благодаря применению катализаторов можно достичь высокой степени очистки газа, достигающей в ряде случаев 99,9%.
Катализом называют изменение скорости реакции или возбуждение ее, происходящее под действием веществ (катализаторов), которые участвуют в процессе, но в нем не расходуются и к концу реакции остаются химически неизменными, хотя физически могут изменяться. Различают два вида катализа: гомогенный (однородный) и гетерогенный (неоднородный).
При гомогенном катализе реагирующие вещества и катализатор образуют однофазную систему (жидкую или газовую). Примером гомогенного катализа могут служить реакции горения водорода и оксида углерода, в которых роль катализаторов выполняют активированные частицы.
При гетерогенном катализе катализатор составляет самостоятельную фазу (обычно твердую). Этот тип катализа получил очень широкое распространение в промышленности. Большую часть продукции, вырабатываемой химической и смежными отраслями промышленности, получают с помощью гетерогенного катализа, как правило газового, т. е. когда ускоряются реакции газовой фазы. Менее распространен гетерогенный катализ в жидкой фазе.
Каталитические реакции подчиняются общим законам химии и термодинамики, но имеют при этом свои особенности, так как в них всегда участвует один дополнительный компонент — катализатор. Действие катализаторов принципиально отличается от действия других факторов, способствующих интенсификации химических реакций, например температуры, давления, радиационного воздействия. Повышение температуры может ускорять реакцию вследствие увеличения энергетического уровня реагирующих молекул, т. е. их активации за счет вводимой извне теплоты. При этом изменяется внутренняя энергия системы и смещается положение равновесия.
Катализатор не влияет ни на равновесие химической реакции, ни на другие термодинамические характеристики реакций. Изменяя в равной степени скорость прямой и обратной реакций, он способствует повышению скорости достижения равновесия при данных условиях.
Ускоряющее действие катализаторов сводится к понижению энергии активации реакций образующихся промежуточных соединений. Это следует из уравнения Аррениуса:
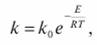 (7.81).
(7.81).
где k — константа скорости реакции; k0 — пред экспоненциальный множитель; Е — энергия активации; R — газовая постоянная; Т — абсолютная температура.
Ускоряющее действие катализатора выражают его активностью А, характеризующей отношение констант скоростей реакций, происходящих с участием катализатора kк и без него k:
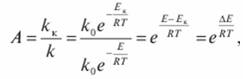 (7.82).
(7.82).
где E, ЕК — энергия активации реакции без катализатора и в присутствии катализатора; ?? = Е — ЕК — снижение энергии активации в присутствии катализатора.
Например, реакция разложения аммиака в отсутствие катализатора имеет энергию активации 297 400 Дж/моль, а при наличии ванадиевого катализатора — только 163 800 Дж/моль, энергия активации процесса разложения оксида азота без катализатора и с платиновым катализатором соответственно 245 700 и 136 500 Дж/моль.
Ускоряющее действие катализатора можно проследить на примере окисления сернистого ангидрида:
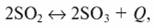 (7.83).
(7.83).
которая в отсутствие катализатора протекает крайне медленно [при 420 °C (623 К) энергия активации составляет Е = 420 000 Дж/(моль · К)]. При проведении этой реакции на ванадиевом катализаторе энергия активации составляет Ек = 268 000 Дж/(моль · К). Подставив эти величины в уравнение (7.82) и учитывая, что R = 8,3 Дж/(моль · К), получаем:

т.е. скорость реакции возрастает в сотни миллиардов раз.
Основным достоинством каталитического метода очистки газов является то, что он дает высокую степень очистки, а недостатком — образование новых веществ, которые надо удалять из газа абсорбцией или адсорбцией.
Катализаторы. Каталитические взаимодействия в гетерогенном катализе происходят на границе раздела фаз газовой смеси и поверхности катализатора.
В качестве эффективных катализаторов приходится применять дорогостоящие вещества — платину, палладий, рутений; используют и более дешевые — никель, хром, медь, но они менее эффективны. В процессах санитарной каталитической очистки отходящих газов высокой активностью обладают катализаторы на основе благородных металлов (платина, палладий, серебро и др.), оксидов марганца, меди, кобальта, а также оксидные контактные массы, активированные благородными металлами (1,0… 1,5%).
Твердые катализаторы, которые наиболее распространены, чаще всего выпускают в виде зерен, таблеток, гранул. Это в основном металлы и их оксиды, например медь, серебро, платина, платиноиды, хром, молибден, железо, никель, кобальт и др. Часто металлы используют в виде дисперсий на поверхности носителей.
Катализаторы должны обладать высокой активностью и теплопроводимостью, развитой пористой структурой, стойкостью к каталитическим ядам, механической прочностью, селективностью, термостойкостью, иметь низкие температуры «зажигания», обладать низким гидравлическим сопротивлением.
Температурой зажигания катализатора называют минимальную температуру реагирующей смеси, при которой процесс начинает протекать с достаточной скоростью. Чем активнее катализатор, тем ниже температура зажигания.
Важной особенностью катализаторов является их избирательность (селективность) по отношению к определенным реакциям. Селективность катализатора состоит в том, что во многих случаях он избирательно увеличивает скорость только определенной реакции, не влияя заметно на скорость других, возможных в данной системе. При этом температура протекания катализируемой реакции понижается, вследствие чего другие возможные реакции не идут.
Избирательность действия катализатора Iкат можно определить как отношение скорости образования целевого продукта к суммарной скорости превращения основного исходного реагента, в нашем случае загрязняющего агента, по всем направлениям:
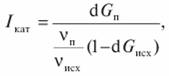 (7.84).
(7.84).
где GП — количество продукта; Gисх — количество основного исходного реагента; vп/vисх — соотношение стехиометрических коэффициентов при образовании продукта из основного исходного вещества.
В процессе эксплуатации катализаторы в той или иной степени подвергаются постепенной дезактивации или деструкции, которые вызываются химическими отравлениями, каталитическими ядами, механическим истиранием, спеканием, агрегатированием, что приводит к необходимости периодической регенерации (активации) или замены катализаторов.
На эффективность действия катализаторов зачастую влияют другие вещества (каталитические яды и промоторы).
Отравление катализатора — это частичная или полная потеря его активности в результате действия посторонних примесей — контактных ядов. Отравление может быть обратимым и необратимым. При обратимом отравлении примеси снижают активность катализатора только при их присутствии в зоне катализа, при удалении ядов катализатор восстанавливает свою прежнюю активность. При необратимом отравлении активность катализатора не восстанавливается и после удаления контактных ядов из зоны реакции.
Каталитические яды — это вещества, снижающие или полностью уничтожающие активность катализаторов. К ним относятся, например, соединения мышьяка, ртути, свинца, цианиды, отравляющие платиновые катализаторы. В производственных условиях реагирующие вещества стараются очищать от каталитических ядов, а отравленные катализаторы регенерируют.
Промоторы — вещества, усиливающие действие катализаторов. Например, платиновые катализаторы промотируют добавками железа, алюминия и др.
Кинетика реакций гетерогенного катализа. Снижение энергии активации реакции в присутствии катализатора объясняется образованием промежуточных соединений (активированных комплексов). Изменение реакционного пути происходит в этом случае благодаря образованию промежуточных непрочных продуктов взаимодействия реагирующих веществ с катализатором.
Вначале катализатор и реагирующее вещество образуют промежуточное соединение, которое затем реагирует с другим исходным веществом, давая конечные продукты реакции и высвобождая катализатор. Промежуточные соединения очень нестойки, с малым периодом жизни, существуют только в процессе катализа. Их свойства резко отличаются от свойств аналогичных соединений, образующих объемную фазу.
Схематично реакцию между исходными веществами А, B с участием катализатора К можно представить следующим образом:
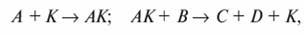 (7.85).
(7.85).
где AКактивированное промежуточное соединение; С и D — продукты реакции.
Гетерогенное каталитическое превращение является сложным многоступенчатым процессом, включающим:
диффузию исходных реагентов из ядра газового потока к поверхности гранул катализатора (внешняя диффузия);
проникание этих веществ в порах катализатора к активным центрам его внутренней поверхности (внутренняя диффузия);
активированную адсорбцию (хемосорбцию) продиффундировавших реагентов поверхностью катализатора с образованием поверхностных химических соединений;
химическое взаимодействие адсорбированных веществ с образованием новых продуктов;
десорбцию продуктов и их перенос к наружной поверхности гранул катализатора (внутренняя диффузия);
перенос продукта реакции от поверхности катализатора в ядро газового потока (внешняя диффузия).
Константа скорости каталитического превращения при данной температуре является функцией констант скоростей прямой, обратной и побочной реакций, а также коэффициентов диффузии исходных реагентов и продуктов их взаимодействия. Скорость гетерогенного каталитического процесса определяется относительными скоростями отдельных его стадий и лимитируется наиболее медленной из них.
В общем случае суммарное уравнение скорости всего процесса гетерогенного катализа должно включать описание его стадий. Известно, что наиболее медленной стадией, лимитирующей процесс, является диффузионный перенос газообразного вещества через пограничный слой газа, т. е. внешнедиффузионная область.
Если каталитический процесс идет во внешнедиффузионной области, то его скорость и определяется коэффициентом диффузии реагентов и продуктов реакции в газе. По закону Фика при постоянстве условий диффузии.
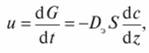
где G — количество компонента, перенесенное за время t в направлении z, перпендикулярном поверхности зерна катализатора, при концентрации с диффундирующего компонента в ядре потока реагентов (продуктов реакции); Dэ — эффективный коэффициент диффузии, определяемый совокупностью молекулярной и турбулентной (конвективной) диффузии; S — свободная поверхность зерен катализатора.
В случае когда скорость реакции по загрязняющему компоненту, А лимитируется внешней диффузией, скорость переноса этого компонента к поверхности зерен катализатора можно определить по уравнению массоотдачи:
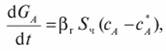 (7.86).
(7.86).
где ?г — коэффициент массоотдачи в газовой фазе; Sч — внешняя поверхность частицы катализатора; 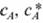 - концентрации компонента, А в газовом потоке и его равновесная концентрация на поверхности частицы катализатора.
- концентрации компонента, А в газовом потоке и его равновесная концентрация на поверхности частицы катализатора.
Для внутридиффузионной области и реакции первого порядка суммарную скорость каталитического процесса находят, комбинируя уравнение массопередачи с уравнением диффузии и реакции внутри частицы:
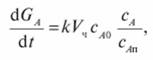 (7.87).
(7.87).
где k — константа скорости реакции, отнесенная к 1 м3 катализатора; Vч — объем частиц катализатора; сА0 — начальная концентрация компонента; сА — средняя концентрация компонента, А внутри поры; сАП — максимально возможная концентрация компонента, А у поверхности катализатора.
Общее уравнение скорости каталитического процесса, протекающего в кинетической области, с учетом основных технологических параметров (концентрации, температуры, давления и активности катализатора):
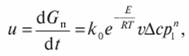 (7.88).
(7.88).
где 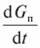 - приращение количества продукта во времени; v — насыпной объем катализатора; ?с — движущая сила процесса при атмосферном давлении; р1 — безразмерное давление, т. е. отношение действительного давления к атмосферному; n — порядок реакции.
- приращение количества продукта во времени; v — насыпной объем катализатора; ?с — движущая сила процесса при атмосферном давлении; р1 — безразмерное давление, т. е. отношение действительного давления к атмосферному; n — порядок реакции.
Интенсивность или скорость каталитического превращения может быть выражена в общем виде через количество конвертируемой в единицу времени t примеси GА или количество образующегося в единицу времени продукта GП каталитического взаимодействия:
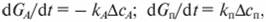 (7.89).
(7.89).
где kA, kП — соответственно константы скорости процессов по обезвреживаемому компоненту, А и продукту реакции; ?сА, ?сП — соответственно движущая сила процессов конверсии компонента, А и продукта реакции.