Реальные газы.
Курс общей физики.
Книга 3: термодинамика, статистическая физика, строение вещества

Если молекула состоит из различных атомов, то центр тяжести внешних электронов уже не будет находиться посередине между атомами, а будет смещен к тому или другому атому. В некоторых случаях все внешние электроны (когда их немного, один или два) одного атома переходят к другому атому, который превращается таким образом в отрицательно заряженный ион. Так, например, происходит при образовании… Читать ещё >
Реальные газы. Курс общей физики. Книга 3: термодинамика, статистическая физика, строение вещества (реферат, курсовая, диплом, контрольная)
Межмолекулярное взаимодействие
Молекулы состоят из атомов. Каждый атом в свою очередь состоит из одного положительно заряженного массивного ядра и нескольких отрицательно заряженных сравнительно легких электронов. Атом в целом нейтрален, так как отрицательный заряд всех его электронов равен по величине заряду ядра. Заряд одного электрона равен — е, где е — так называемый элементарный электрический заряд. Если число электронов в атоме равно Z, то заряд ядра будет равен +Ze. Электроны удерживаются в пределах атома электрическими силами притяжения к ядру. Какие же силы заставляют нейтральные атомы притягиваться друг к другу и образовывать молекулы? Оказывается, эти силы также имеют электрическую природу, т. е. обусловлены взаимодействием заряженных частиц.
Движение электронов в атоме имеет довольно сложный характер. Одни электроны движутся близко к ядру, а другие — сравнительно далеко от него. Поэтому одни электроны называются внутренними электронами атома, а другие — внешними, или валентными. Для внешних электронов кулоновская сила притяжения к ядру.
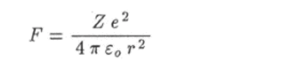
принимает меньшие значения, чем для внутренних, т. е. внешние электроны слабее связаны с ядром, чем внутренние. Под влиянием каких-либо воздействий внешние электроны легко изменяют характер своего движения и даже могут покидать пределы атома. Тогда атом превращается в положительно заряженный ион. Характер движения внешних электронов существенно изменяется при сближении двух и более атомов. Как говорят, происходит перестройка внешних оболочек атомов. Если в результате этого энергия системы уменьшается, то атомы образуют более или менее прочную молекулу. Рассмотрим несколько примеров образования устойчивых связей атомов в молекуле.
Такие молекулы, как молекулы водорода #г, кислорода Ог и азота Яг, образованы из двух одинаковых атомов. Связь атомов в этих молекулах можно объяснить следующим образом. Ядро каждого атома притягивает к себе электроны другого атома. Поэтому внешние электроны в молекуле движутся так, что их концентрация в пространстве между атомами повышается (рис. 6.1).
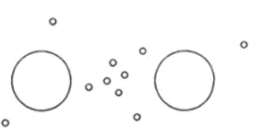
Рис. 6.1. Ковалентная связь.
Для того чтобы лучше понять механизм образования связи и оценить силу притяжения атомов, рассмотрим упрощенную модель двухатомной молекулы. Предположим, что внешние электроны полностью оторвались от атомов и сконцентрировались в середине молекулы на расстоянии а от образовавшихся ионов (рис. 6.2). Если заряд одного иона равен +qt то суммарный заряд внешних электронов будет равен —2 q. На каждый ион действует сила отталкивания 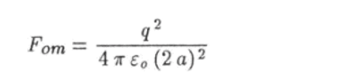
со стороны другого иона и сила притяжения.
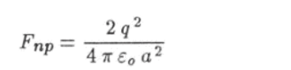
к сосредоточенному между ними заряду внешних электронов. При этом сила притяжения в восемь раз больше силы отталкивания: 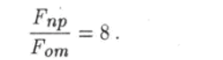
В действительности заряд внешних электронов не сконцентрирован в точке, а распределен некоторым образом в пространстве. Поэтому сила притяжения имеет меньшее значение, но все-таки она больше силы отталкивания. Образованная таким образом связь атомов в молекуле называется ‘ковалентной.
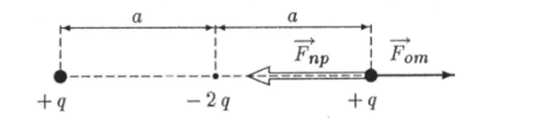
Рис. 6.2. Упрощенная модель ковалентной связи двух атомов.
Если молекула состоит из различных атомов, то центр тяжести внешних электронов уже не будет находиться посередине между атомами, а будет смещен к тому или другому атому. В некоторых случаях все внешние электроны (когда их немного, один или два) одного атома переходят к другому атому, который превращается таким образом в отрицательно заряженный ион. Так, например, происходит при образовании молекулы из атомов натрия Na и хлора С1. Один внешний электрон атома натрия переходит к атому хлора (рис. 6.3). Между ионами действуют кулоновские силы притяжения, которые обеспечивают прочность молекулы. Такая связь называется ионной.
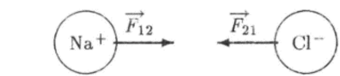
Рис. 6.«У. Молекула NaCl. Ионная связь.
Система заряженных частиц, для которых ' центры тяжести" отрицательных и положительных зарядов не совпадают, называется электрическим диполем. Например, молекула NaCl является электрическим диполем.

Рис. 6.4. Силы Ван-дер-Ваалъса.
Нод действием внешнего электрического поля сферически симметричный атом превращается в электрический диполь (помризуется). Взаимная поляризация атомов происходит при их сближении. Атомы, превратившиеся в электрические диполи, притягиваются друг к другу (рис.
6.4). При этом они еще больше поляризуют друг друга. Силы, обусловленные взаимной поляризацией атомов или молекул, называются дисперсионными, или силами Ван-дер-Ваалъса. Таким образом, при сближении атомов между ними начинают действовать силы притяжения, которые имеют электрическое происхождение и определяются характером движения внешних электронов в образовавшейся молекуле.
При малых расстояниях между атомами преобладают силы отталкивания, обусловленные кулоновским взаимодействием положительно заряженных ядер.
Какой-либо универсальной формулы, описывающей зависимость силы взаимодействия двух атомов от расстояния г между ними, не существует. Однако для любых атомов эта зависимость имеет общий характер: при больших расстояниях (г > г0) атомы притягиваются друг к другу, а при малых (г < г0) — отталкиваются (рис. 6.5). Проведем через центры двух атомов прямую. Центр одного из атомов выберем за начало отсчета расстояния между ними, т. е. будем считать этот атом как бы неподвижным. Из рис. 6.5 видно, что проекция F на ось г силы F, которая действует на подвижный атом, будет.

График зависимости проекции F силы от расстояния г между атомами приведен на рис. 6.6.
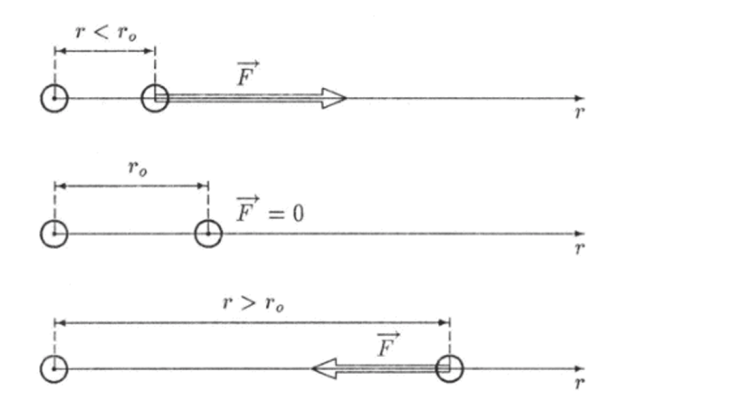
Рис. 6.5. Сила мсясмолскулярпого взаимодействия
На рис. 6.7 приведен график зависимости от расстояния г потенциальной энергии W = W® взаимодействия двух атомов, которая связана с проекцией силы соотношением.
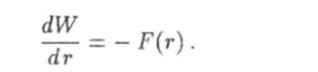
Из этой формулы следует, что 1) при расстояниях г > г0) когда атомы притягиваются и сила F отрицательна, производная функции W = V® положительна, а сама функция является возрастающей; 2) при расстояниях г < г0 атомы отталкиваются, сила F положительна, производная функции W = W{r) отрицательна и эта функция убывает. При г = г0 потенциальная энергия двух атомов принимает наименьшее значение Wmin. Как известно, потенциальная энергия определена с точностью до произвольною постоянного слагаемого. Эта постоянная величина будет равна нулю, если принять условие, что при удалении атомов друг от друга на бесконечно большое расстояние энергия их взаимодействия должна обращаться в ноль: 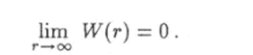
При этом условии наименьшее значение Wmtn потенциальной энергии будет отрицательным:

где W0 — положительная величина.
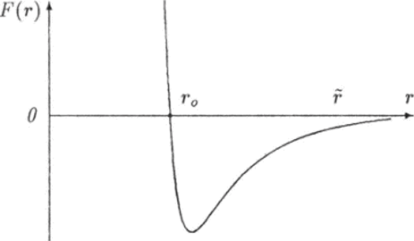
Рис. 6.6. График зависимости силы взаимодействия двух молекул от расстояния между ними.
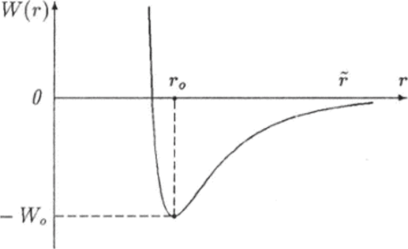
Рис. 6.7. График зависимости потенциальной энергии взаимодействия двух молекул от расстояния между ними.
Все сказанное в этом разделе о взаимодействии атомов относится с небольшими изменениями к взаимодействию молекул. Так же, как и атомы, молекулы при малых расстояниях между ними отталкиваются, а при не очень больших притягиваются друг к другу. При некотором расстоянии d между молекулами сила их взаимодействия равна нулю, а потенциальная энергия принимает наименьшее значение — V0. Для одинаковых молекул величину d условились называть эффективным диаметром молекулы.
Важно отметить, что силы меж молекулярного взаимодействия являются короткодействующими, т. е. проявляют себя только, когда расстояние между молекулами принимает значения г < г, где расстояние г называется радиусом действия межмолекулярных сил. Это расстояние равно всего нескольким диаметрам молекул. При расстояниях г > г молекулы практически не взаимодействуют.