Реакции горения вещества в воздухе

Где — нижний (верхний) температурный предел распространения пламени; -температура кипений, оС; ,-константы для определенных групп (гомологических рядов) жидкостей. Определить количество сгоревшего вещества, кг, если заданный объем выделившейся при сгорании (СО2) двуокиси углерода, приведенный к нормальным условиям, составил: Весь объем вступивших в реакцию компонентов (1+2,5+2,5Ч3,76) принимаем… Читать ещё >
Реакции горения вещества в воздухе (реферат, курсовая, диплом, контрольная)
Задача 1
Условия: Рассчитать теоретически необходимое количество воздуха для сгорания m кг вещества при Т=-20 °С и Р=780 мм рт. ст.
Дано: Амилбензол C11H16;
m=3кг;
Т=-20 °С (253 К);
Р=780 мм рт. ст.(103 991 Па) Найти:
Решение: Горючее — индивидуальное химическое соединение, поэтому для расчёта используем формулу:, кг/м3
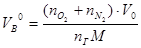
1) Составим уравнение химической реакции горения без учета стехиометрических коэффициентов:
C11H16 + O2 + 3,76N2 => CO2 + H2O + 3,76N2
2) Расставляем стехиометрические коэффициенты в реакции горения: проверяем по O2
C11H16 + 15 (O2 + 3,76N2) => 11CO2 + 8H2O + 15· 3,76N2
найдём их значения: nC11H16=1; nO2=15; nN2=15· 3,76=56,4.
3) Определяем молекулярную массу бензола: M=11· 12+1·16=148.
Объем 1 кмоля газа при нормальных условиях составляет 22,4 м3
= 10.806 м3/кг.
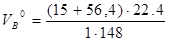
Для определения объёма воздуха при горении в условиях, отличных от нормальных, пользуются уравнением состояния идеальных газов:
.
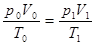
м3
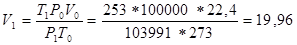
Тогда теоретический объём воздуха для сгорания вещества массой m = 3 кг составит: воздух сгорание горючий газ.
Vв=V1· mв = 19,96· 3= 59,88 м3
Ответ: Теоритическое количество воздуха C11H16 составляет VВ0 =59,88 м3
Задача 2.
Условие: Рассчитать теоретически необходимое количество воздуха для сгорания V м3 горючего газа.
Дано: Ацителен C2H2;
Vв = 25 м3.
Найти: Vв0;
Решение:
1) Составим уравнение химической реакции горения без учета стехиометрических коэффициентов:
C2H2 + O2 + 3,76N2 => CO2 + H2O + 3,76N2
2)Расставляем стехиометрические коэффициенты в реакции горения:
C2H2 + 2,5 (O2 + 3,76N2)=> 2CO2 + H2O + 2,5· 3,76N2
найдём их значения: nC2H2=1; nO2=2,5; nN2 = 2,5· 3,76=9,4.
3) Определяем теоретически необходимое количество воздуха:
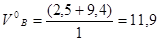
м3/м3.
4) Для определения коэффициента избытка воздуха воспользуемся формулой: ;
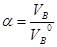
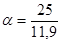
=2,1.
Ответ: Теоритически необходимое количество воздуха C2H6 составляет:
VВ0 = 11,9 м3; = 2,1.
Задача 3.
Условия: Определить объем продуктов горения при сгорании 1 кг Амилбензола, если температура кипения Т=1200 К, давление.
P=740 мм рт.ст., =1,1.
Дано: Амилбензол C11H16;
Т=1200 К;
Р=740 мм рт.ст.,.
=1,1.
Найти: V0пг
Решение:
1) Горючее — индивидуальное химическое соединение. Запишем уравнение химической реакции горения:
C11H16 + 15O2 + 15· 3,76N2 => 11CO2 + 8H2O + 15· 3,76 N2
- 2) Молекулярная масса горючего: М=11· 12+1·16=148.
- 3) Теоретический объём продуктов горения при нормальных условиях:
;
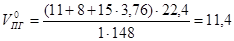
м3/кг.
4) Практический объём воздуха при нормальных условиях:
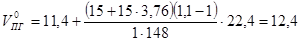
м3/кг.
5) Объём продуктов горения при заданных условиях:
м3/м3
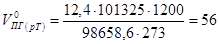
Ответ: Объем продуктов горения V0ПГ=56 м3/м3
Задача 4.
Условия: Определить объем и состав (% об.) продуктов горения, выделившихся при сгорании 1 м3 Ацителена, если температура горения составила T=1200 К, давление P=750 мм рт.ст.
Дано: Ацителен C2H2
T=1200 К,.
P=750 мм рт.ст.
Найти: V0пг
Решение:
1) Составим уравнение химической реакции:
C2H2 + 2,5O2 + 2,5· 3,76N2 => 2CO2 + H2O + 2,5· 3,76N2
1) Определим состав продуктов горения Ацителена:
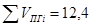
VCO2=2 кмоля; VH2O=1 кмоля; VN2= 9,4 кмоля; кмоля По формуле находим состав продуктов горения:
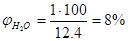
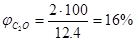
; ;
2) Определим объем для газа при нормальных условиях:
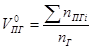
м3/м3
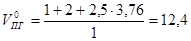
Объём продуктов горения при T=1200 К и давлении P=750 мм рт.ст.
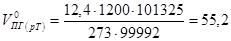
м3/м3
Ответ: V0пг=55,2 м3/м3;; ;
Задача 6.
Условие: Рассчитать концентрационные пределы распространения пламени паров i-ro вещества в воздухе. Результаты расчета сравнить с имеющимися справочными данными и определить относительную ошибку.
Дано: C11H16 Амилбензол Найти:
Решение: Расчёт КПР пламени проводим по аппроксимационной формуле. Определяем значение стехиометрического коэффициента при кислороде:
C11H16+15O2=>11CO2+8H2O.
Расставим стехиометрические коэффициенты, сделав проверку по кислороду O2: C11H16+15O2=>11CO2+8H2O.
Следовательно: n = 15.
тогда значения констант нижнего КПР a =8.684 и b=4.679, а значение констант верхнего КПР т.к. n >7,5 принимаем, а = 0,768; b = 6,554 соответственно.
Определим Нижний и верхний КПР пламени, подставив их значения:
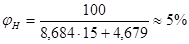
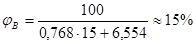
Ответ: НКПР = 5% и ВКПР = 15%.
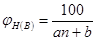
Задача 8.
Условие: Амилбензол C11H16
Атмосферное давление — нормальное: 760 мм.рт.ст.
Определить температурные пределы распространения пламени, если его концентрационные пределы в воздухе равны 5 — 15%.
Решение: По формуле определим давление насыщенного пара амилового спирта, соответствующее нижнему и верхнему температурным пределам распространения пламени где давление насыщенного пара, соответствующее нижнему (верхнему) концентрационному пределу воспламенения; - нижний (верхний) концентрационный предел распространения пламени; - атмосферное давление.
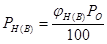
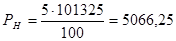
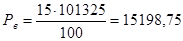
Па; Па.
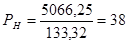
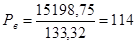
мм.рт.ст.; мм.рт.ст.
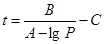
Из уравнения Антуана следует: .
Из табличных данных находим значение констант А, В и С для амилового спирта:
А = 6,92 129; В = 1457,020; С = 176,195.
lоgPН = lоg38=1,5797; lоgPВ =lоg114 = 2,0569.
Находим температурные пределы распространения (ТПР).
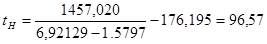
оС = 369,82 К;
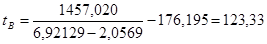
°С = 396,33 К.
Температурные пределы отличны от справочных материалов для горючих веществ.
Задача 5.
Условие: Рассчитать концентрационные пределы распространения пламени паров i-ro вещества в воздухе. Результаты расчета сравнить с имеющимися справочными данными и определить относительную ошибку.
Дано: Амилбензол C11H16
Решение: t = 96 С° до 123 С°.
Константы Антуана: A — 6,92 129; B — 1457,020; СА — 176,195.
Для расчета необходимо определить давление насыщенных паров, соответствующее нижнему (96°С) и верхнему (123оС) пределам распространения пламени.
По уравнению Антуана находим давление насыщенного пара для нижнего и верхнего КПР:
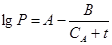
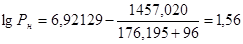
Рн=36,3 мм. рт. ст = 51,2*133,3=4839,83 Па.
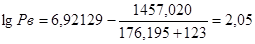
Рв=112.2мм. рт. ст = 1348,9*133,3 = 14 956,50 Па.
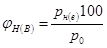
Определим НКПР и ВКПР при нормальных условиях: Р0 = 760 мм рт. ст =101 325 Па, по формуле: ,%
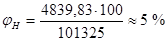
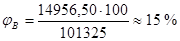
Ответ: для горючего вещества C11H16 НКПР при t = 96 С° составляет, а ВКПР при t = 123 С° равен .
Задача 7.
Рассчитать температурные пределы воспламенения, температуру вспышки паров i-ro вещества в воздухе. Результаты расчета сравнить с имеющимися справочными данными и определить относительную ошибку.
Условия: Амилбензол C11H16
Определить ТПР пламени, если температура его кипения равна 123 °C.
Решение: Расчет проводим по формуле для вещества в жидкой среде:
где — нижний (верхний) температурный предел распространения пламени; -температура кипений, оС; ,-константы для определенных групп (гомологических рядов) жидкостей.
Значение констант принимаем по табличным данным:
kн (в)= 0,6957 (0,7874); lн (в) =73,8(50,3).
tн= 0,6957· 123 — 73,8 = 11,7+273 = 284,7 К;
tв=0,7874· 123 — 50,3=46,5+273=319,5 К.
Определим относительную ошибку расчета. По табличным данным находим, что ТПР пламени составляют: 369−396 К.
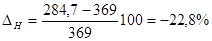
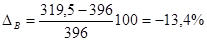
Следовательно, результаты расчета занижены менее чем на 20%.
Определим температуру вспышки, для этого используем формулу Элея:
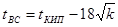
где tВС — температура вспышки, оС; tКИП — температура кипения, оС;
k — Коэффициент, определяющий по формуле:
k=4mC+mH+4mS+mN-2mO-2mCl-3mF-5mBr
где mC, mH, mS, mN, mO, mCl, mF, mBr — количество элементов углерода, водорода, серы, азота, кислорода, хлора, фтора, брома в молекуле горючего вещества.
Для расчета по формуле необходимо принять температуру кипения Амилбензола (C11H16) и значение коэффициента k. Температура кипения 396 К или 123 °C.
Величину k определим по формуле:
k=4· 11+16=44+16=60.
Определим искомую величину температуры вспышки.
= 123 -18= -16,42 оC или 256,58 К.
Согласно справочным данным, температура вспышки Амилбензола равна 343 К (нижний придел ТПР). Определим ошибку расчета:
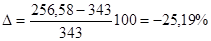
Результат расчета занижен на 25,19%.
Задача 9.
Рассчитать максимальное давление взрыва вещества смеси стехиометрического состава. На момент взрыва давление и температура были близки к нормальным условиям (Ро=105 Па, То = 298 К). Температура взрыва 2905 К.
Условия: Амилбензол С11Н16
Решение.
Определяем состав, и объем исходной смеси и продуктов горения. Запишем уравнение химической реакции:
С11H16+ 15(O2+3,76*N2)=11CO2+8H2O+15*3,76*N2
Из уравнения реакции следует: количество исходной смеси стехиометрического состава равно 70 моля; количество продуктов сгорания 75,4 моля.
Рассчитываем максимальное давление взрыва воздушной смеси вещества:
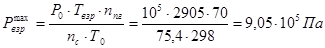
Избыточное давления взрыва Р будет равно:
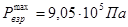
Ответ: Па;
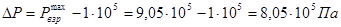
Задача 10.
Рассчитать безопасную концентрацию кислорода при разбавлении углекислым газом (CO2) смеси паров вещества в воздухе.
Условия: Амлибензол C11H16.
Решение.
По табличным данным находим теплоту образования Амилбензол (C11H16) 298*103Дж/моль. Из химической формулы Амилбензол (C11H16) следует, что тс=11, тн=16, то=0. Значения остальных параметров, необходимые для расчета по формуле:, выбираем по табличным данным для двуокиси углерода (CO2):
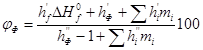
=0,735*10-5; =0,579; (=1,251;=0,418;=0,542); =2,020;
(=4,642;=1,160;=-2,321).
,
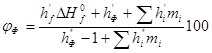
где — стандартная теплота образования горючего, Дж/моль; (по справочным материалам);, , — константы, зависящие от вида химического элемента в молекуле горючего и вида флегматизатора; - количество атомов i-го элемента (структурной группы) в молекуле горючего.
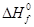
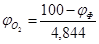
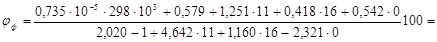
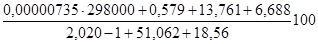
= 32,8%.
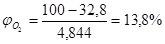
Следовательно, при снижении концентрации кислорода в четырехкомпонентной системе, состоящей из паров ацетона, двуокиси углерода, азота и кислорода, до 12,36% смесь становится взрывобезопасной.
Задача 11.
Рассчитать тротиловый эквивалент взрыва вещества Условия: Амилбензола С11Н16.
Решение.
Теплота взрыва Амилбензола принимается равной его низшей теплоте сгорания. Значение Qн для (С5Н12О) составляет 6002,2 (6,002 *103) кДж/моль.
При пересчете на 1 кг вещества теплота взрыва составит, для этого определим молекулярную массу вещества:
M С11H16=12*11+1*16=148*10-3 кг/моль.
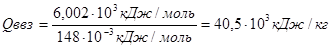
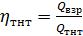
Согласно соотношению тротиловый эквивалент взрыва вещества в смеси стехиометрического состава будет:
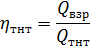
где — 4,187*103 кДж/кг — теплота взрыва тротила (тринитротолуола).
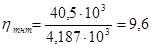
Тогда Ответ:
Задача 12.
Определить низшую теплоту сгорания вещества, если известна теплота ее образования.
Условие: Амилбензол C11H16
Теплота образования — 298 кДж/моль Решение.
Для расчета составим уравнение горения вещества в кислороде:
C11H16 +15O2= 11CO2+8H2O.
CO2=396,6 кДж/моль,.
H2O = 242,2 кДж/моль.
Qн = (11*396, 6+8*242, 2−1*298) = 6002,2кДж/моль6,002*103 кДж/кмоль.
Для расчета количества тепла, выделяющегося при горении 1 кг горючего, необходимо полученную величину разделить на его молекулярную массу (148) (C11H16 = 12*11+16*1=148).
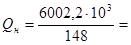
40 555 кДж/кг.
Ответ: Qн = 40 555 кДж/кг.
Задача 13.
Рассчитать теплоту сгорания 1 м3 стехиометрической воздушной смеси вещества.
Условие: Ацетилен C2H2
CO2=396,6 кДж/моль,.
H2O =242,2 кДж/моль.
C2H2=-224,6 кДж/моль Решение.
Находим стехиометрический состав горючей смеси по уравнению реакции горения:
C2H2+2,5(O2+*3,76N2)=2CO2+Н2О+2,5*3,76N2
Весь объем вступивших в реакцию компонентов (1+2,5+2,5Ч3,76) принимаем за 100%, а количество горючего (1 кмоль) будет соответствовать стехиометрической концентрации.
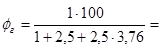
7,75%.
Теплоту сгорания 1 м3 вещества определим по формуле:
Qн = 2*396,6+2*242,2+224,6 = 1502,2 кДж/моль.
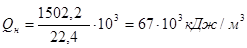
где объем 1 кмоля газа при стандартных условиях равен 22,4 м3
Теплоту сгорания 1 м3 стехиометрической воздушной смеси вещества определим по формуле:
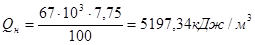
Ответ: Q = 5197,34 кДж/м3.
Задача 14.
Определить количество сгоревшего вещества, кг, если заданный объем выделившейся при сгорании (СО2) двуокиси углерода, приведенный к нормальным условиям, составил:
Условие: Амилбензол С11Н16
V (CO2) = 11,9 м3
Решение.
Запишем уравнение реакции горения вещества в воздухе С11Н16 +15(O2+*3,76N2)=11CO2+8H2O+15*3,76N2
Из уравнения следует, что при горении 148 кг (молекулярная масса амилбензола) выделяется 11Ч22,4 м3 двуокиси углерода.
Тогда для образования 11,9 м3 двуокиси углерода должно вступить в реакцию mГ горючего:
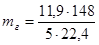
= 15,72 кг.
Ответ: mг =15,72 кг Задача 15.
Определить интенсивность тепловыделения на пожаре органической массы заданного вещества при известной QН (по данным задачи 12), если скорость выгорания 0,015кг/(м2· с), а площадь пожара 150 м2.
Условия: Амилбензол C11H16
QН = 40 555 кДж/кг.
Решение: Согласно формуле где qn — интенсивность тепловыделения, кВт;
F — площадь горения, м2;
— скорость выгорания, кг/(м2· с) Ответ: q=91,2 МВт.