Современные подходы к классификации, диагностике и ведению больных с хроническим гастритом в свете международного Киотского консенсуса

Во втором разделе, посвященном H. pylori— ассоциированной диспепсии, отмечено, что инфекция H. pylori сама по себе может приводить к появлению симптоматики у части больных с диспепсией. Во-первых, естественное или ятрогенное инфицирование может вызывать острые диспепсические симптомы. Во-вторых, данные большинства эпидемиологических исследований свидетельствуют о четкой ассоциации между наличием… Читать ещё >
Современные подходы к классификации, диагностике и ведению больных с хроническим гастритом в свете международного Киотского консенсуса (реферат, курсовая, диплом, контрольная)
Десятилетиями такие эндоскопические понятия как «гастриты» и «эрозии» даже с гистологическим подтверждением наличия воспаления слизистой оболочки желудка (СОЖ) достаточного внимания клиницистов не привлекали, поскольку абсолютное большинство таких пациентов были асимптоматичными. Хотя понятие «гастрит» нередко используют для описания диспепсических симптомов, наличие последних плохо коррелирует с гистологическими или эндоскопическими данными. Поэтому термин «гастрит» следует применять не столько для объяснения симптомов диспепсии, сколько для описания воспаления СОЖ, часто сопровождающегося ее структурными изменениями, такими как пептические язвы, рак желудка или атрофический гастрит с пернициозной анемией. Долгое время причины воспаления СОЖ оставались неясными и лишь открытие инфекции Helicobacter pylori позволило установить истинную и наиболее частую причину хронического гастрита (ХГ). H. pylori вызывает прогрессирующее повреждение СОЖ. В настоящее время эту инфекцию рассматривают как основной причинный фактор ХГ, а также таких клинически важных заболеваний, как пептические желудочные или дуоденальные язвы, аденокарцинома желудка и MALT-лимфома (мальтома) желудка.
Как известно, в Международной статистической классификации болезней и сопутствующих проблем здоровья 10-го пересмотра (МКБ-10), принятой Генеральной ассамблеей ВОЗ в 1990 г. и обязательной для использования всеми странами-участниками ВОЗ с 1994 г., H. pylori-ассоциированные гастриты в разделе К29, посвященном гастритам, отсутствуют. В отношении гастритов в МКБ-10 применен не этиологический принцип, а сочетание этиологических и фенотипических подходов. В них также включены дуодениты. Кроме того, если считать H. pylori- ассоциированные гастриты инфекционными заболеваниями, то рассмотрение H. pylori-ассоциированных диспепсических симптомов как проявлений функциональной диспепсии (ФД) вызывает сомнение, несмотря на то, что H. pylori при ФД играет определенную патогенетическую роль. В диагностике гастроэнтерологических заболеваний в последние десятилетия наблюдается выраженный технический прогресс. Так, новые виды эндоскопии (эндоскопия с увеличением, эндоскопия в узком спектре и др.) позволяют с высокой степенью точности установить диагноз «гастрит» даже без гистологического подтверждения. Такие неинвазивные диагностические тесты, как 13С-мочевинный дыхательный тест, фекальный антигенный тест и серологическое определение пепсиногена, также рассматриваются как суррогатные маркеры H. pylori— позитивного гастрита и его выраженности. Дополнительно к существующей Международной Сиднейской классификации гастритов сейчас широко применяют новые гистологические классификации гастрита и кишечной метаплазии (соответственно OLGA и OLGAIM), которые также требуют оценки и согласования [14, 15]. В 2013 г. в Японии государственная страховая политика включила эрадикационную терапию H. pylori-позитивных гастритов после проведения верхней эндоскопии (для исключения более серьезных заболеваний, таких как пептические язвы и рак) в перечень обязательных методов лечения [16]. Однако до последнего времени не было международного консенсуса, регламентирующего проведение эрадикации при H. pylori-позитивном гастрите и дальнейшее наблюдение больных.
В феврале 2014 г. в г. Киото (Япония) состоялась международная согласительная конференция, основной целью которой была разработка новой классификации гастритов и достижение международного консенсуса по диагностике и ведению больных с H. pylori-позитивным гастритом и ФД, а также по профилактике рака желудка [16].
Киотский консенсус содержит 4 раздела. Первый из них посвящен новой этиологической классификации гастритов, включенной в МКБ 11-го пересмотра. Во втором разделе рассмотрены вопросы, связанные с H. pylori-ассоциированной диспепсией, в третьем — современная диагностика ХГ, в четвертом — ведение больных с H. pylori-индуцированными гастритами.
Участники Киотского консенсуса пришли к выводу, что прежняя классификация гастритов безнадежно устарела, нуждается в коренном пересмотре и должна быть основана на этиологическом принципе, отраженном в новой МКБ 11-го пересмотра (в редакции от 20 января 2015 г.).
Киотская этиологическая классификация гастрита
Helicobacter pylori-индуцированный гастрит Медикаментозно-индуцированный гастрит Аутоиммунный гастрит Стресс-индуцированный гастрит Специальные формы гастрита.
- • Аллергический гастрит
- • Гастрит вследствие билиарного рефлюкса
- • Лимфоцитарный гастрит
- • Болезнь Менетрие
- • Эозинофильный гастрит Инфекционный гастрит
- • Желудочная флегмона
- • Бактериальный гастрит
- — H. pylori-индуцированный гастрит
- — Энтерококковый гастрит
- — Микобактериальный гастрит: туберкулезный; нетуберкулезный микобактериальный
- — Вторичный сифилитический гастрит
- • Вирусный гастрит
- — Цитомегаловирусный
- — Энтеровирусный
- • Грибковый гастрит
- — Гастрит вследствие мукоромикоза
- — Кандидоз желудка
- — Гистоплазмоз желудка
- • Гастрит, вызванный паразитами
- — Анизокиаз желудка
- — Криптоспоридиаз желудка
- — Стронгилоидоз желудка Гастрит вследствие других заболеваний
- • Болезни Крона
- • Саркоидоза
- • Васкулита
Гастрит вследствие внешних причин.
- • Алкогольный
- • Радиационный
- • Химический
- • Другие.
В последующих положениях Консенсуса отмечено, что ХГ целесообразно разделять в зависимости от типа, выраженности, гистологических и эндоскопических особенностей, поскольку это определяет индивидуальный риск развития серьезных осложнений, в частности рака желудка, а также имеет большое значение для выделения групп больных с повышенным риском после проведения эрадикации и пациентов, которым необходимо регулярное эндоскопическое и гистологическое наблюдение. В частности, пациенты с тяжелым атрофическим гастритом (с/без кишечной метаплазии) или преимущественным фундальным гастритом более склонны к прогрессированию в рак желудка кишечного или диффузного типа. Для оценки риска развития рака желудка в клиническую практику должны быть широко внедрены новые стадийные системы морфологической классификации ХГ — OLGA и/или OLGIM [14, 15].
Пятое положение Консенсуса рекомендует эрозии желудка (поверхностные повреждения СОЖ диаметром от 3 до 5 мм) рассматривать отдельно от ХГ, поскольку их развитие и течение зависит от этиологии и нуждается в уточнении. Хотя эрозии желудка могут рассматриваться в контексте H. pylori, однако значительно чаще они вызваны воздействием гастротоксичных препаратов, в первую очередь ацетилсалициловой кислоты и нестероидных противовоспалительных препаратов (НПВП). Кроме того, нередко даже после эрадикации H. pylori могут отмечаться морфологические формы в виде плоских, приподнятых или геморрагических эрозий, вероятно, связанных с постэрадикационной гиперсекрецией кислоты. В любом случае наличие множественных эрозий на фоне приема НПВП повышает риск развития пептических язв в последующем [16].
Шестое положение Консенсуса утверждает, что в настоящее время H. pylori-индуцированные ХГ независимо от наличия/отсутствия симптомов и/или осложнений должны рассматриваться как инфекционное заболевание. У всех инфицированных пациентов развивается хронический активный гастрит разной степени выраженности с разным риском прогрессирования, который может быть как клинически незначимым, так и вызывать серьезные осложнения вплоть до рака желудка. Эрадикация H. pylori приводит к заживлению воспаленной СОЖ, вылечиванию пептических язв, снижению риска серьезных осложнений и может сопровождаться полным восстановлением нормальной СОЖ. При прогрессировании ХГ до атрофических форм с кишечной метаплазией или без нее, а также при тяжелых фундальных ХГ риск рака желудка повышен, поэтому в таких случаях эрадикация инфекции должна сочетаться с последующим наблюдением [16].
Во втором разделе, посвященном H. pylori— ассоциированной диспепсии, отмечено, что инфекция H. pylori сама по себе может приводить к появлению симптоматики у части больных с диспепсией. Во-первых, естественное или ятрогенное инфицирование может вызывать острые диспепсические симптомы. Во-вторых, данные большинства эпидемиологических исследований свидетельствуют о четкой ассоциации между наличием H. pylori и неисследованной диспепсией, а эрадикация приводит к небольшому, но статистически значимому улучшению симптоматики у больных с ФД (количество больных, нуждающихся в лечении, — от 8 до 12). В настоящее время не существует критериев, позволяющих предсказать, окажет ли эрадикация симптоматический эффект у больных с ФД или нет. Поэтому в клинической практике возможна только одна стратегия ведения пациентов — проводить эрадикационную терапию и в течение 6 мес (средний период времени, необходимый для восстановления СОЖ) ждать, произойдет ли полное разрешение симптоматики или необходимо дополнительное лечение. В связи с этим в соответствующих положениях Консенсуса рекомендуется отдельно рассматривать H. pylori— ассоциированную диспепсию и ФД. Если у H. pylori-инфицированного больного с диспепсией при отсутствии структурных изменений со стороны СОЖ после эрадикационной терапии отмечается стойкое улучшение симптоматики (в течение 6—12 мес), то таких пациентов следует отнести к категории пациентов, имеющих H. pylori-ассоциированную диспепсию. Всех других пациентов без первичного ответа на эрадикационную терапию или имеющих рецидив симптоматики рекомендуется рассматривать как больных с ФД, требующих другого лечения (рис. 1). Согласно восьмому положению Консенсуса эрадикационное лечение инфекции H. pylori следует рассматривать как первую линию лечения у всех больных с диспепсией, инфицированных H. pylori, поскольку успешная эрадикация инфекции позволяет вылечить ХГ и значительно уменьшить риск развития пептических язв и рака желудка у большинства больных, улучшить симптоматику у части пациентов, является непродолжительным и относительно безопасным методом лечения [16].
В третьем разделе Консенсуса, посвященном диагностике гастритов, отмечено, что надежная диагностика атрофии СОЖ и кишечной метаплазии может быть проведена при помощи новых методов эндоскопии, таких как хромоэндоскопия, эндоскопия высокого разрешения с уве-личением и усиленная эндоскопия (NBIили BLI-эндоскопия) с увеличением, даже без взятия биопсии и проведения гистологического исследования [2, 4, 7, 13].
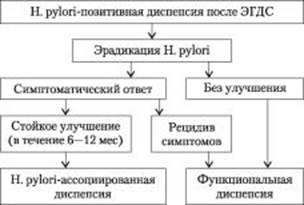
Рис. 1. Алгоритм ведения больного с H. pylori-позитивной диспепсией
Хотя эти методы рутинно сейчас применяют только в Японии, их внедрение в эндоскопическую практику в других странах стремительно увеличивается. Новые методы эндоскопии позволяют заподозрить наличие предраковых изменений СОЖ (после соответствующего тренинга специалистов) и целенаправленно взять биоптат из подозрительных участков тела желудка и его антрального отдела. Последующее гистоморфологическое исследование согласно морфологическим классификациям OLGA и OLGIM позволяет провести первичную стратификацию риска больных путем их разделения в зависимости от стадии (с учетом степени тяжести атрофии и кишечной метаплазии) [3, 10, 13, 14, 15]. Согласно масштабному исследованию, проведенному в Нидерландах и включавшему 98 тыс. пациентов с предраковыми изменениями СОЖ, средний риск развития рака в течение ближайших 10 лет составил 2—3% (0,8, 1,8, 3,9 и 32,7% для пациентов с атрофическим гастритом, кишечной метаплазией, дисплазией низкой и высокой степени, соответственно) [16].
Кроме того, для стратификации риска рака желудка полезными являются такие неинвазивные серологические тесты, как определение уровня пепсиногена I и II, соотношения пепсиноген I/пепсиноген II и антител к H. pylori. Проведенный в Японии скрининг 9293 больных показал, что у больных с нормальным уровнем пепсиногена I прогрессирование гастрита в рак желудка маловероятно, несмотря на наличие H. pylori. У больных с низким уровнем пепсиногена, предполагающим наличие атрофии СОЖ, риск развития рака существенно выше (3—6 случаев на 1000 пациентов в год) [1, 12]. С учетом этих данных рекомендуется широко внедрять стратегию to search and screen (искать и проводить скрининг) для H. pylori-индуцированного ХГ, желательно — еще до развития атрофического гастрита и кишечной метаплазии [16].
В четвертом разделе Консенсуса, посвященном ведению больных с гастритом, рекомендуется проводить эрадикационную терапию всем H. pylori-инфицированным пациентам, не имеющим противопоказаний, или при отсутствии конкурирующих соображений. Инфекция H. pylori в настоящее время рассматривается как главный патоген человека, вызывающий хроническое и прогрессирующее повреждение СОЖ, этиологически связанное с пептическими язвами, атрофией СОЖ и раком желудка. Кроме того, эта инфекция тесно связана с развитием MALT-лимфом желудка, диспепсии, гиперпластических полипов и идиопатической тромбоцитопенической пурпуры. H. pylori-инфицирован- ные индивидуумы также являются основным резервуаром трансмиссии этой инфекции. H. pylori — хроническая инфекция, сходная с асимптоматическим сифилисом или туберкулезом, исход которой у конкретного больного пока нельзя предсказать [16].
Потенциальные преимущества эрадикации для инфицированного пациента — прекращение прогрессирования повреждения СОЖ, стабилизация или уменьшение риска развития рака желудка и пептических язв, разрешение воспаления СОЖ, стабилизация или восстановление функции желудка, включая желудочную секрецию, вылечивание пептических язв и снижение риска НПВП-гастропатий [8]. Потенциальные преимущества эрадикации для общества в целом заключаются в уменьшении пула инфицированных, что снижает риск трансмиссии инфекции другим индивидуумам, а также в снижении стоимости диагностики и лечения H. pyloriассоциированных болезней [9]. Поэтому согласно 17-му положению Консенсуса каждому инфицированному пациенту должна быть проведена эрадикационная терапия, если нет противопоказаний или конкурирующих соображений, например, сопутствующей патологии, высокого риска реинфекции, других приоритетов здоровья в обществе или высокой стоимости. Максимальные преимущества эрадикации отмечаются в тех случаях, когда еще не развивалось атрофия СОЖ, поэтому ее желательно проводить как можно раньше, преимущественно у лиц молодого возраста.
Режимы эрадикации инфекции H. pylori в разных географических областях могут отличаться и должны быть основаны на схемах лечения, наиболее эффективных в конкретном регионе и надежно обеспечивающих уровень эрадикации > 90%. В идеале режимы эрадикации следует выбирать с учетом данных о резистентности H. pylori к антибиотикам в регионе. Согласно рекомендациям Маастрихтского консенсуса 4 (2010), если резистентность к кларитромицину в регионе не превышает 15%, то, как и прежде, в качестве первой линии лечения рекомендуется стандартная тройная кларитромицин-содержащая терапия даже без предварительного определения чувствительности (уровень доказательств А, класс рекомендаций І) [11].
Если резистентность к кларитромицину в регионе превышает 15— 20%, а чувствительность к антибактериальным препаратам у конкретного индивидуума до лечения не была определена, то стандартную тройную терапию назначать не следует. В качестве первой линии лечения следует назначить классическую квадротерапию (ингибитор протонной помпы (ИПП) + метронидазол + тетрациклин + висмут) в течение 10 дней. Если такая терапия недоступна, то назначают либо последовательную терапию (первые 5 дней — ИПП + амоксициллин, последующие 5 дней — ИПП + кларитромицин + тинидазол или метронидазол), либо несодержащую препараты висмута квадротерапию (ИПП + амоксициллин + кларитромицин + метронидазол) в течение 10 дней (уровень доказательств А, класс рекомендаций І).
По данным Европейского регистра больных, которым проведена эрадикационная терапия в 2014—2015 гг., у 61% из 11 272 больных применена стандартная тройная терапия, у 16% — невисмутовая квадротерапия, у 11% — последовательная терапия, у 7% — висмутовая квадротерапия. Общий уровень эрадикации при анализе эффективности всех линий лечения составил 80%, а результаты 10-дневной стандартной тройной, последовательной, сопутствующей и висмутовой квадротерапии — соответственно 78, 87, 90 и 92% эрадикации. Таким образом, классическая квадротерапия на основе висмута, по последним данным, надежно обеспечивает высокий и рекомендуемый уровень эрадикации (90% и выше), при этом она является относительно дешевой и дает существенно меньшее количество побочных эффектов. Наиболее эффективным препаратом висмута с доказанной эффективностью, который прошел испытание временем и прекрасно зарекомендовал себя как в Украине, так и в других странах, является «Де-Нол» (коллоидный субцитрат висмута компании «Астеллас»). Кроме высокой эффективности при проведении первой линии эрадикационной терапии, «Де-Нол» способен преодолеть кларитромицин-резистентность инфекции H. pylori, тем самым повышая эффективность второй линии лечения (в среднем — на 8—14%). За более чем 20-летний период применения препарата «Де-Нол» в Украине не зафиксировано ни одного случая осложнений или возникновения заболеваний, связанных с терапевтической дозировкой препарата.
Эффективность проведенной эрадикации должна быть подтверждена во всех случаях, желательно — путем проведения неинвазивных тестов (13С-мочевинный дыхательный тест, фекальный антигенный тест). В заключительном положении Консенсуса отмечено, что удачная эрадикация H. pylori хотя и значительно снижает риск развития рака желудка в последующем, но полностью не устраняет. Поэтому пациентов следует стратифицировать на группы риска в зависимости от выраженности и протяженности атрофии СОЖ для того, чтобы в дальнейшем провести периодическое эндоскопическое и гистоморфологическое наблюдение (рис. 2). Согласно Европейским рекомендацим по ведению больных с пренеопластическими изменениями СОЖ, у пациентов с выраженной атрофией СОЖ и/или кишечной метаплазией эндоскопическое и морфологическое наблюдение следует проводить с интервалом 3 года, при наличии дисплазии низкой степени — с интервалом 1 год, а при наличии дисплазии высокой степени — с интервалом 6 мес [5, 6].
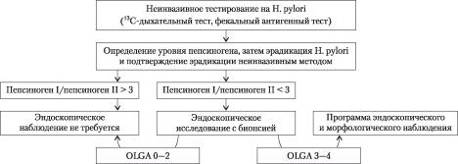
Рис. 2. Алгоритм ведения больного с H. pylori-индуцированным гастритом
Таким образом, Киотский консенсус по H. pylori-индуцированным гастритам представляет новый набор ключевых характеристик гастритов, которые привязаны как к гистологической картине, так и к верхним абдоминальным симптомам. Несмотря на то, что ХГ представляют собой отдельную нозологическую клинически важную форму, многие поколения гастроэнтерологов пренебрегали и пренебрегают необходимостью его лечения. Открытие H. pylori революционизировало прежние представления о природе гастродуоденальной патологии и обозначило этот уникальный инфекционный агент как специфическую причину ХГ, пептических язв и рака желудка.
Международный Киотский консенсус впервые предложил этиологическую классификацию гастритов и рекомендовал рассматривать H. pylori-индуцированный ХГ как инфекционное заболевание, требующее лечение не столько для облегчения симптоматики, сколько для предупреждения таких осложнений, как пептические язвы и рак желудка. В качестве первой линии лечения ХГ всем инфицированным больным строго показана эрадикация H. pylori. Такой подход хоть и не гарантирует полное устранение риска рака желудка, однако значительно его уменьшает. Больным, у которых уже имеются предраковые изменения, даже после эрадикации H. pylori необходимо проводить эндоскопическое и гистоморфологическое наблюдение. Хотя еще имеется много нерешенных или дискутабельных вопросов, тем не менее рекомендации Киотского консенсуса следует рассматривать как непосредственное руководство к действию. В ближайшем будущем это позволит поднять наши знания на качественно новый уровень, а также существенно улучшить результаты лечения и прогноз у большого количества пациентов.
гастрит helicobacter руlогі рак.
- 1. Agreus L., Kuipers E. J., Kupcinskas L. et al. Rationale in diagnosis and screening of atrophic gastritis with stomach-specific plasma biomarkers // Scand. J. Gastroenterol. — 2012. — Vol. 47. — P. 136—147.
- 2. Anagnostopoulos G. K., Yao K., Kaye P. et al. High-resolution magnification endoscopy can reliably identify normal gastric mucosa, Helicobacter pylori-associated gastritis and gastric atrophy // Endoscopy. — 2007. — Vol. 39. — P. 202—207.
- 3. Capelle L. G., de Vries A. C., Haringsma J. et al. The staging of gastritis with the OLGA system by using intestinal metaplasia as an accurate alternative for atrophic gastritis // Gastrointest. Endosc. — 2010. — Vol. 71. — P. 1150—1158.
- 4. Capelle L. G., Haringsma J., de Vries A. C. et al. Narrow band imaging for the detection of gastric intestinal metaplasia and dysplasia during surveillance endoscopy // Dig. Dis. Sci. — 2010. — Vol. 55. — P. 3442—3448.
- 5. De Vries A. C., Haringsma J., de Vries R. A. et al. Biopsy strategies for endoscopic surveillance of pre-malignant gastric lesions // Helicobacter. — 2010. — Vol. 15. — P 259—264.
- 6. Dinis-Ribeiro M., Areia M., de Vries A. C. et al. Management of precancerous conditions and lesions in the stomach (MAPS): guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP) // Endoscopy. — 2012. — Vol. 44. — P. 74.
- 7. Gonen C., Simsek I., Sarioglu S. et al. Comparison of high resolution magnifying endoscopy and standard videoendoscopy for the diagnosis of Helicobacter pylori gastritis in routine clinical practice: a prospective study // Helicobacter. — 2009. — Vol. 14. — P. 12—21.
- 8. Graham D. Y., Lee Y. C., Wu M. S. Rational Helicobacter pylori therapy: evidence-based medicine rather than medicinebased evidence // Clin. Gastroenterol. Hepatol. — 2014. — Vol. 12. — P 177—186.
- 9. Lee Y. C., Chen T. H., Chiu H. M. et al. The benefit of mass eradication of Helicobacter pylori infection: a community-based study of gastric cancer prevention // Gut. — 2013. — Vol. 62. — P. 676—682.
- 10. Lim J. H., Kim N., Lee H. S. et al. Correlation between endoscopic and histological diagnoses of gastric intestinal metaplasia // Gut Liver. — 2013. — Vol. 7. — P. 41 — 50.
- 11. Malfertheiner P., Megraud F, O’Morain C. A. et al. Management of Helicobacter pylori infection — the Maastricht IV Florence Consensus Report // Gut. — 2012. — Vol. 61. — P. 646—664.
- 12. Miki K. Gastric cancer screening by combined assay for serum anti-Helicobacter pylori IgG antibody and serum pepsinogen levels-«ABC method» // Proc. Jpn. Acad. Ser. B Phys. Biol. Sci. — 2011. — Vol. 87. — P. 405—414.
- 13. Osawa H., Yamamoto H., Miura Y. et al. Blue laser imaging provides excellent endsocopic images of upper gastrointestinal lesions // Video J. Encyclopedia of GI Endoscopy. — 2014. — Vol. 1. — P. 607—610.
- 14. Rugge M., de Boni M., Pennelli G. et al. Gastritis OLGA-staging and gastric cancer risk: a twelve-year clinico-pathological follow-up study // Aliment. Pharmacol. Ther. — 2010. — Vol. 31. — P 1104—1111.
- 15. Rugge M., Correa P, Di Mario F et al. OLGA staging for gastritis: a tutorial // Dig. Liv. Dis. — 2008. — Vol. 40. — P. 650—658.
- 16. Sugano K., Tack J., Kuipers E. J. et al. Kyoto global consensus report on management of Helicobacter pylori gastritis // Gut. — 2015. — Vol.