Лекция № 16. Аминокислоты.
Пептиды

Аминокислоты — гетерофункциональные соединения, содержащие одну или две карбоксильные и аминогруппы. По природе радикала различают алифатические и ароматические аминокислоты. По взаимному расположению функциональных групп выделяют б-, Я-, ги т.д. аминокислоты. Наибольшее значение среди аминокислот имеют б-аминокислоты, которые широко распространены в природе и, будучи составными частями белков… Читать ещё >
Лекция № 16. Аминокислоты. Пептиды (реферат, курсовая, диплом, контрольная)
План.
- 1. Классификация аминокислот.
- 2. Строение, номенклатура, свойства аминокислот.
- 3. Полипептиды.
Аминокислоты — гетерофункциональные соединения, содержащие одну или две карбоксильные и аминогруппы. По природе радикала различают алифатические и ароматические аминокислоты. По взаимному расположению функциональных групп выделяют б-, Я-, ги т.д. аминокислоты. Наибольшее значение среди аминокислот имеют б-аминокислоты, которые широко распространены в природе и, будучи составными частями белков, участвуют в процессах жизнедеятельности организмов. Из природных объектов выделено около 200 аминокислот, из белков — около двадцати, среди которых незаменимые аминокислоты: лизин, треонин, триптофан, метионин, фенилаланин, лейцин, изолейцин и валин.
Номенклатура. Названия алифатических аминокислот составляют по номенклатуре ИЮПАК, некоторые кислоты имеют тривиальные названия.
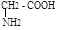
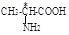

аминоэтановая 2-аминопропановая 3-аминопропановая аминоуксусная б-аминопропионовая Я-аминопропионовая глицин аланин.
Изомерия. Для аминокислот характерны сруктурная и оптическая изомерия.
Структурная изомерия: а) изомерия углеродного скелета; б) изомерия положения аминогруппы (например, би Я-аминопропионовые кислоты).
Некоторые аминокислоты содержат асимметрический атом углерода и могут существовать в виде пары энантиомеров. Например,.
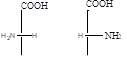


б-аминокислота L-ряд D-ряд.
S-конфиг. R-конфиг. S-конфиг. R-конфиг.
Большинство природных б-аминокислот принадлежит к стерическому L-ряду (S-конфигурация). Аминокислоты D-ряда обнаружены в некоторых антибиотиках.
Получение.
а) Аминирование галогензамещенных карбоновых кислот, применяется для получения аминокислот любого типа:

- б) Присоединение аммиака к б, Я-непредельным карбоновым кислотам
- (получения Я-аминокислот):
- в) Образование и гидролиз аминонитрилов (получения б-аминокислот):


г) Восстановительное аминирование оксокислот:

д) Из оксимов циклических кетонов перегруппировкой Бекмана:

Метод используется для синтеза е-аминокислот.
е) Восстановление нитроароматических кислот:
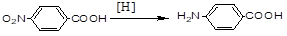
Химические свойства.
Аминокислоты дают реакции, характерные для карбоксильной и аминогрупп, проявляют специфические свойства, обусловленные наличием двух функциональных групп и их взаимным расположением.
а) Кислотно-основные свойства
Молекулы аминокислот имеют две функциональные группы, противоположные по характеру, кислую карбоксильную группу и основную аминогруппу, являются амфотерными соединениями. В кристаллическом состоянии существуют в виде внутренних солей, т. е. биполярных ионов:
Для ароматических аминокислот образование биполярных ионов менее характерно из-за меньшей основности аминогруппы.
Аминокислоты — нелетучие кристаллические вещества с высокими температурами плавления. Они нерастворимы в неполярных органических растворителях и растворимы в воде. Их молекулы обладают большими дипольными моментами.
Поведение биполярного иона в водных растворах:
в кислой среде аминокислоты присоединяют протон и существуют преимущественно в виде катионов Н3N+-R-COO- + H+ — Н3N+-R-COOH,.
в щелочной среде биполярный ион отдает протон и превращается в анион Н3N+-R-COO- + OH- — Н2N-R-COO- + HOH.
Значение рН, при котором молекула аминокислоты находится в растворе в виде биполярного иона, называется изоэлектрической точкой. Для б-аминокислот рН ~ 6,1.
Диаминокарбоновые кислоты или аминодикарбоновые кислоты также образуют внутренние соли, но из-за присутствия второй аминоили карбоксильной группы сохраняют основную или кислую реакцию.
б) Реакции карбоксильной группы
Аминокислотам присущи характерные свойства карбоновых кислот — образование солей сложных эфиров.

образование галогенангидридов и ангидридов требует предварительной защиты аминогруппы, например ацилированием.
в) Реакции аминогруппы
Аминокислоты дают все реакции первичных аминов (см. «Амины») — взаимодействие с азотистой кислотой, алкилирование и ацилирование в щелочной среде.
- г) Реакции с одновременным участием карбоксильной и аминогрупп:
- 1. образование пептидной связи

, полученное соединение называется дипептидом.
2. отношение к нагреванию б-аминокислот (образование дикетопиперазинов):

в-аминокислот (образование непредельных кислот):
Н3N+-CH2-CHR-COO- > CH2=CR-COOH + NH3,.
г, д, е-аминокислот (образование циклических амидов — лактамов):
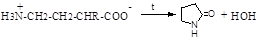
д) действие окислителей на б-аминокислоты сопровождается образованием альдегидов:

Пептиды. Петиды — это полиамиды — продукты поликонденсации, построенные из б-аминокислот. По числу аминокислотных остатков в молекуле пептида различают дипептиды, трипептиды, тетрапептиды и т. д. Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами, более 10 аминокислотных остатков — полипептидами. Природные полипептиды, включающие более 100 аминокислотных остатков, называют белками
Название пептида строят на основе тривиальных названий входящих в его состав аминокислотных остатков, которые перечисляют, начиная со свободной аминогруппы. При этом в названиях всех аминокислот, за исключением последней, суффикс «ин» заменяют на суффикс «ил».
Белки наряду с нуклеиновыми кислотами играют важную роль в живой природе. Число белков велико, разнообразны и их функции. Существуют простые белки (протеины) и сложные белки (протеиды), содержащие и небелковую часть.
Различают несколько уровней организации белковых макромолекул: первичная, вторичная, третичная и четвертичная.
Первичная структура — это полипептидная цепь с определенной последовательностью аминокислотных остатков.
Вторичная структура — это определенная пространственная форма полипептидной цепи: б-спираль и структура складчатого листа (вструктура). Вторичная структура образована водородными связями.
N-Н…О=С.
Третичная структура характеризует пространственное расположение б-спирали или другой формы вторичной структуры.
Четвертичная структура характеризует ассоциацию нескольких полипептидных цепей.
Поскольку белки построены из молекул б-аминокислот, то они по химическим свойствам им подобны. Белки обладают амфотерными свойствами. Существуют качественные реакции, определяющие особенности в строении молекулы белка. Для белков характерно явление осаждения: обратимое осаждение или высаливание и необратимое осаждение или денатурация.
Знаете ли вы, что.
- — В 1820 году французский химик Анри Браконно в результате длительного нагревания кожи, сухожилий получил первую аминокислоту, сладкую на вкус — гликоколл (глицин).
- -В 1838 году голландский химик Г. Мульдер обнаружил в составе этого соединения азот.
- -В 1843 году Э Хорсфорд установил формулу этого вещества.
- -п-Аминобензойная кислота (ПАБК) способствует росту микроорганизмов, является витамином, обеспечивающим нормальный обмен веществ, её сложные эфиры — анестетики (анестезин, новокаин).
- -г-Аминомасляная кислота (ГАМК) — принимает участие в метаболических процессах в головном мозге и является нейромедиатором.
- -Глутаминовая кислота и ее соли используют в качестве пищевых добавок, усиливающих вкус и аромат продуктов. Впервые эти соединения из сушенных водорослей выделил в 1909 году японский ученый К. Икеда.
- -Глицин используется в качестве лекарственного средства, укрепляющего организм и стимулирующего работу головного мозга.
- -Аспартам — дипептид, синтетический заменитель сахара, слаще которого в 300 раз. Добавляют в газированные напитки, жевательную резинку; вызывает некоторые заболевания, нарушает обмен веществ.
- -В 1963 году из отдельных аминокислот осуществлен синтез природного белка — инсулина (гормон поджелудочной железы, регулирует в организме содержание глюкозы в крови).