Индикаторы кислотно-основного титрования
В растворах кислотно-основных индикаторов одновременно происходят равновесные процессы диссоциации молекул и внутримолекулярных перегруппировок одних форм индикаторов в другие, отличающихся по своему строению. Таким образом, изменение цвета индикатора в результате присоединения ионов водорода при действии кислот или отнятия ионов Н+ при действии оснований сопряжено со смещением ионных равновесий… Читать ещё >
Индикаторы кислотно-основного титрования (реферат, курсовая, диплом, контрольная)
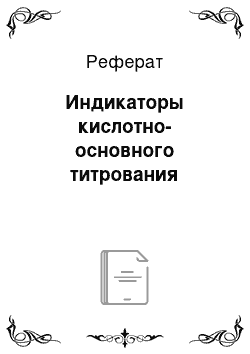
Индикаторы кислотно-основного титрования — слабые органические кислоты (или слабые основания), у которых недиссоциированные молекулы и образуемые ими ионы имеют различную окраску. Поэтому они носят общее название кислотно-основных индикаторов. Индикаторы, обладающие свойством присоединять протоны, называют основными индикаторами и обозначают IndOH, где Ind — катион индикатора. Такие индикаторы диссоциируют по схеме.
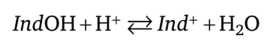
Индикаторы, обладающие свойством отдавать протоны, называют кислотными индикаторами и обозначают НInd. Молекула такого индикатора играет роль донора протона, т. е. дает при диссоциации катион Н+ и анион Ind~. Существуют одноцветные (например, фенолфталеин) и двухцветные (например, метиловый оранжевый) индикаторы.
Кислотно-основные индикаторы должны отвечать следующим основным требованиям:
- — окраска индикатора должна быть интенсивной и различаться в кислой и щелочной среде;
- — изменение окраски должно быть быстрым, четким и обратимым;
- — окраска индикатора должна меняться в узком интервале изменения pH раствора;
- — индикатор должен быть чувствительным и менять свою окраску в присутствии минимального избытка кислоты или щелочи;
- — индикатор должен быть стабильным, не разлагаться в водном растворе и на воздухе.
Для объяснения природы изменения окраски кислотно-основных индикаторов предложены различные теории: ионная, хромофорная, ионно-хромофорная.
Ионная теория была предложена В. Оствальдом (1S53—1932). Согласно ей нейтральная и ионизированная формы индикатора обладают различной окраской. Например, индикатор — слабая кислота Hind. В водном растворе индикатора устанавливается равновесие:

При увеличении концентрации ионов водорода (понижение pH раствора) равновесие диссоциации индикатора будет смещаться влево — в сторону молекулярной формы индикатора, концентрация которой будет повышаться и при определенном значении pH будет преобладать в растворе, придав ему красный цвет. Напротив, при уменьшении концентрации ионов водорода (повышении pH), т. е. при добавлении щелочи к раствору, равновесие диссоциации индикатора будет смещаться вправо — в сторону ионизированной формы индикатора (/nd_), концентрация ее будет повышаться по мере увеличения pH и при определенном значении pH раствор окрасится в синий цвет — ионизированная форма индикатора будет преобладать в растворе. В табл. 17.1 указана окраска недиссоциированных молекул и ионов некоторых индикаторов.
Таблица 17.1
Окраска некоторых индикаторов.
Индикатор | Окраска недиссоциированных молекул. | Окраска ионов. |
Метиловый оранжевый. | Красная. | Желтая. |
Метиловый красный. | Красная. | Желтая. |
Лакмус. | Красная. | Синяя. |
Фенолфталеин. | Бесцветная. | Малиновая. |
Тимолфталеин. | Бесцветная. | Синяя. |
Бромтимоловый синий. | Желтая. | Синяя. |
Если упрощенно обозначить молекулы фенолфталеина через Hind, а анионы его — через Ind~, то уравнение диссоциации будет иметь вид.

При добавлении к раствору, содержащему фенолфталеин, немного щелочи введенные ионы ОНстанут связывать протоны с образованием малодиссоциирующих молекул воды. При этом равновесие диссоциации индикатора сместится вправо и накопление анионов Indr вызовет окрашивание раствора в малиновый цвет.
Ионная теория обладает рядом недостатков: она не объясняет механизм и кинетику процесса изменения окраски индикаторов; не учитывает строения их молекул и др.
Хромофорная теория кислотно-основных индикаторов объясняет наличие окраски присутствием в молекулах индикаторов хромофорных групп (хромофоров). Хромофоры (носители цветности), т. е. особые группы атомов с сопряженными двойными связями и неподеленными парами электронов:
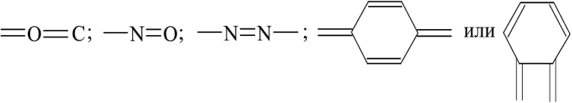
Последняя группировка атомов называется хиноидной. При изменении pH раствора или при диссоциации хромофоры могут перегруппировываться. Перемена окраски индикаторов, согласно хромофорной теории, — это результат изменений в их внутреннем строении. У одноцветных индикаторов это связано с появлением или исчезновением хромофоров. У двухцветных индикаторов эти изменения обусловлены превращением одних хромофоров в другие.
Типичный одноцветный индикатор—фенолфталеин. При pH < 8 молекулы его не содержат хиноидной группировки и поэтому бесцветны. Однако при действии щелочи на фенолфталеин (pH 8—10) образуется анион, который включает хиноидную группировку и обеспечивает малиновую окраску.

Дальнейшее увеличение pH (до 13—14) вызывает новую перегруппировку, в результате чего получается соль, лишенная хиноидной группировки и поэтому бесцветная:

Вследствие этого фенолфталеин обесцвечивается при действии большого избытка щелочи.
Типичным двухцветным индикатором можно считать метиловый оранжевый:

В водном растворе он оранжевый, при pH 4,4 желтую окраску. Объясняется это тем, что азот азотгруппы индикатора обладает свойством присоединять катион Н+ кислоты и индикатор превращается в ион красного цвета. Таким образом, при действии кислот наблюдается переход желтой окраски метилового оранжевого в красную, а при действии оснований происходит обратное превращение. Иначе говоря, кислотно-основные индикаторы могут существовать в двух взаимопереходящих (таутомерных) формах, имеющих различную окраску.

Хромофорная теория объясняет наличие окраски, но не объясняет причины таутомерных превращений и изменения окраски индикатора при изменении pH раствора, а также того факта, что окраска некоторых индикаторов может меняться мгновенно, по типу ионных реакций.
Ионно-хромофорная теория объединяет представления ионной и хромофорной теорий. Согласно этой теории кислотно-основные индикаторы представляют собой слабые кислоты и основания, причем молекула индикатора и ионная форма индикатора содержат разные хромофоры. Переход из одной формы в другую происходит под действием ионов Н+ и ОНпоскольку одна из форм индикатора является слабой органической кислотой или слабым основанием. На окраску индикаторов влияет также присутствие в соединениях других группировок, называемых ауксохромами. К последним относят группы —ОН, —NH2 и их производные, содержащие те или иные радикалы, например группы —ОСН3, —N (CH3)2 и т. п. В противоположность хромофорам ауксохромы сами не сообщают окраску индикаторам, но обладают свойством усиливать действие хромофоров, повышая интенсивность вызываемой ими окраски.
В растворах кислотно-основных индикаторов одновременно происходят равновесные процессы диссоциации молекул и внутримолекулярных перегруппировок одних форм индикаторов в другие, отличающихся по своему строению. Таким образом, изменение цвета индикатора в результате присоединения ионов водорода при действии кислот или отнятия ионов Н+ при действии оснований сопряжено со смещением ионных равновесий индикатора, связанных с изменением его структуры. Свойство молекул различных индикаторов диссоциировать в нейтральной среде характеризуют константами диссоциации. Например, у метилового оранжевого Кд = 1СИ, у лакмуса Ка = 10~8, а у фенолфталеина Кд = lCh9. Следовательно, фенолфталеин является наиболее слабой органической кислотой из этих индикаторов.
Прибавление к любому раствору кислоты или щелочи влечет за собой изменение концентрации ионов Н+ в нем, а следовательно, и pH. Перемена окраски у индикаторов также связана с изменением pH раствора. Однако каждый индикатор изменяет окраску только в определенном, характерном для него интервале значений pH. Так, если к раствору кислоты прибавить несколько капель фенолфталеина и постепенно нейтрализовать кислоту щелочью, то концентрация ионов Н+ станет постепенно уменьшаться, а pH раствора расти. Но индикатор останется бесцветным, как и до прибавления щелочи. Даже когда вся кислота будет нейтрализована и pH станет несколько больше 7, окраска раствора еще не изменится. Малиновое окрашивание фенолфталеина появится лишь при pH 9. По мере дальнейшего прибавления щелочи интенсивность окраски раствора будет увеличиваться, но только до pH 10. После этого окраска индикатора перестанет изменяться (рис. 17.1). Таким образом, интенсивность окраски фенолфталеина меняется в интервале pH от 8 до 10.
Интервал значений pH, в пределах которого индикатор изменяет свою окраску, называют областью перехода индикатора. Область перехода метилового оранжевого (см. рис. 17.1) находится в пределах pH от 4,4 до 3,1. Внутри этого интервала окраска индикатора переходит из желтой в розовую. При pH > 4,4 он сохраняет желтую окраску, а при pH < 3,1 — розовую.
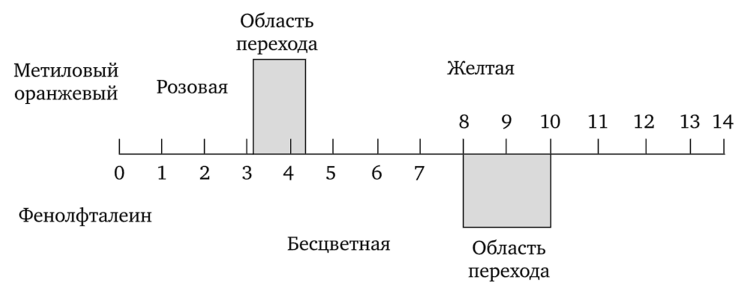
Рис. 17.1. Окраска фенолфталеина и метилового оранжевого при различных значениях pH.
Для сужения области перехода окраски и увеличения контрастности применяют смешанные индикаторы, которые составляют из индикатора и красителя. При определенном значении pH цвет красителя является дополнительным к цвету индикатора, переход окраски — более контрастным.
В ходе титрования раствор приливают до отчетливого изменения окраски индикатора. Окраске индикатора, при которой заканчивают титрование, отвечает определенное значение pH, лежащее внутри области перехода. Значение pH, до которого титруют раствор с данным индикатором, называют показателем титрования этого индикатора (рТ).
На область перехода окраски индикатора (положение и интервал) влияют все факторы, от которых зависит константа равновесия (ионная сила, температура, посторонние вещества, растворитель), а также концентрация индикатора. Интервал перехода окраски индикатора смещается при нагревании: незначительно — у сульфофталеинов и фталеинов (индикаторов-кислот), существенно — у азоиндикаторов и других индикаторов-оснований. Это связано с увеличением значения постоянной воды Кн 0. Область перехода окраски метилового оранжевого, тропеолина и др. смещается в кислую область, например у метилового оранжевого от 3,1—4,4 при 20 °C до 2,5—3,7 при 100 °C.
Из посторонних веществ отметим влияние диоксида углерода и веществ, образующих коллоидные системы. За счет диоксида углерода pH водного раствора уменьшается, поэтому все индикаторы с рТ > 4 чувствительны к С02. На индикаторы сильно влияет присутствие веществ, состоящих из макромолекул, например белков, образующих коллоидные системы. Во-первых, наблюдается взаимодействие кислотных и основных групп белков и индикаторов, во-вторых, индикаторы адсорбируются на поверхности коллоидных частиц (индикаторыоснования — на отрицательно заряженных, а индикаторы-кислоты — на положительно заряженных). Погрешность за счет присутствия коллоидных систем называют белковой ошибкой титрования.
В табл. 17.2 приведены значения показателей титрования кислотноосновных индикаторов.
Следовательно, титрование с фенолфталеином заканчивают, когда раствор имеет щелочную реакцию, с метиловым оранжевым и метиловым красным — при кислой среде раствора. Таким образом, титрование с различными индикаторами прекращают при разных значениях pH, обычно не совпадающих с точкой нейтральности.
Таблица 17.2
Кислотно-основные индикаторы.
Индикатор | Область перехода pH | Показатель титрования рТ (pH) | Изменение окраски |
Метиловый фиолетовый. | 0—1,8. | 1,0. | Желтая —> фиолетовая. |
Тимоловый синий. | 1,2—2,8. | 2,0. | Красная —> желтая. |
Метиловый оранжевый. | ЗД—4,4. | 4,0. | Красная —" желтая. |
Бромкрезоловый зеленый. | 3,9—5,4. | 4,5. | Желтая —> синяя. |
Метиловый красный. | 4,4—6,2. | 5,5. | Красная —> желтая. |
Бромтимоловый синий. | 6,0—7,6. | 7,0. | Желтая —" синяя. |
Феноловый красный. | 6,9—8,4. | 7,5. | Желтая —> красная. |
Тимоловый синий. | 8,0—9,6. | 8,8. | Желтая —> синяя. |
Фенолфталеин. | 8,2—9,8. | 9,0. | Бесцветная —> красная. |
Тимолфталеин. | 9,3—10,5. | 10,0. | Бесцветная —> синяя. |
Ализариновый желтый. | 9,7—12,0. | 11,0. | Бледно-желтая —" буро-красная. |
Лакмус. | 5,0—8,0. | 7,0. | Красная —> синяя. |
Тропеолин 00. | 1,3—3,2. | 2,2. | Красная —> желтая. |
В практике агрохимического и технического анализа нередко применяют так называемые универсальные индикаторы, которые изменяют свою окраску при различных значениях pH (от 1 до 10). Цветные индикаторы очень удобны и в большинстве случаев дают при титровании вполне удовлетворительные результаты. Иногда применение их оказывается затруднительным или вовсе невозможным. Это относится, например, к титрованию мутных, окрашенных или очень разбавленных растворов кислот и оснований. Кроме того, для некоторых реакций еще не найдены подходящие цветные индикаторы. Поэтому для нахождения точки эквивалентности при титриметрических определениях часто используют физико-химические методы. В ходе титрования наблюдают не изменение окраски индикатора, а изменение некоторых электрохимических показателей титруемого раствора: электрической проводимости (кондуктометрическое титрование), окислительно-восстановительного потенциала (потенциометрическое титрование), силы тока (амперометрическое титрование) и т. д. Преимущество определения точки эквивалентности с помощью физико-химических методов состоит в том, что вместо визуального наблюдения за изменением окраски индикатора используют специальные приборы для фиксирования точки эквивалентности.